6.

 下表是氯化钾在不同温度下的溶解度,根据表格回答。
下表是氯化钾在不同温度下的溶解度,根据表格回答。
|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度(克) |
27.6 |
3l |
34 |
37 |
40 |
42.6 |
45.5 |
(1)要制成40℃时氯化钾的饱和溶液,溶液中溶剂和溶质的质量比为5:2;


 (2)40℃时在25克水中加入 25克氯化钾,得到的溶液中溶质的质量分数为28.6%;
(2)40℃时在25克水中加入 25克氯化钾,得到的溶液中溶质的质量分数为28.6%;


 (3)40℃时27%的氯化钾溶液需降温到30℃时,才能刚好成为饱和。
(3)40℃时27%的氯化钾溶液需降温到30℃时,才能刚好成为饱和。


 7.t℃时,硝酸钾的溶解度为s克。在该温度下,把b克硝酸钾投入c克水中充分溶解。
7.t℃时,硝酸钾的溶解度为s克。在该温度下,把b克硝酸钾投入c克水中充分溶解。


 (1)
(1)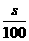 >
>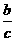 时,溶液中溶质的质量分数为
时,溶液中溶质的质量分数为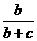 ,此时的溶液为 不饱和
溶液;
,此时的溶液为 不饱和
溶液;


 (2)当
(2)当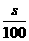 =
=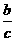 时,溶液中溶质的质量分数为
时,溶液中溶质的质量分数为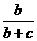 或
或 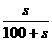 ,此时的溶液
刚好饱和 ;
,此时的溶液
刚好饱和 ;


 (3)当
(3)当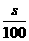 <
<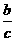 时,溶液中溶质的质量分数为
时,溶液中溶质的质量分数为 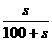 ,此时溶液 饱和且还有部分硝酸钾未溶解 。
,此时溶液 饱和且还有部分硝酸钾未溶解 。


 第17课时
第17课时
2.

 某同学取一杯接近饱和的硝酸钾溶液,进行如下实验,请完成下表。
某同学取一杯接近饱和的硝酸钾溶液,进行如下实验,请完成下表。
|
改变条件 |
实验操作 |
观察到的现象 |
结论 |
|
A.加溶质 |
直到不能溶解为止 |
试管底部有固体不能溶解 |
都变成了   饱和溶液 饱和溶液 |
|
B.蒸发溶剂 |
恒温蒸发水直至有晶体析出 |
试管底部有固体析出 |
|
|
C.降低温度 |
用冰块冷却 |
试管底部有固体析出 |
[科学探究]


 一、溶解性
一、溶解性


 1.一种物质溶解在另一种物质里的能力大小叫溶解性。溶解性是物质的一种特性。
1.一种物质溶解在另一种物质里的能力大小叫溶解性。溶解性是物质的一种特性。


 2.一般地,不同溶质在同一种溶剂里的溶解能力是不同的;同种溶质在不同溶剂里的溶解能力也是不同的。可见一种物质在另一种物质里的溶解能力的大小主要是由
溶质 和 溶剂的性质决定的。例如,食盐容易溶解在 水中,而不易溶解在汽油中;而油脂容易溶解在 汽油 中,而不易溶解在
水 中。
2.一般地,不同溶质在同一种溶剂里的溶解能力是不同的;同种溶质在不同溶剂里的溶解能力也是不同的。可见一种物质在另一种物质里的溶解能力的大小主要是由
溶质 和 溶剂的性质决定的。例如,食盐容易溶解在 水中,而不易溶解在汽油中;而油脂容易溶解在 汽油 中,而不易溶解在
水 中。


 二、溶解度--物质溶解能力的定量表示方法
二、溶解度--物质溶解能力的定量表示方法


 1.固体溶解度的涵义。
1.固体溶解度的涵义。


 在 一定温度 下,某(固体)物质在 100 克溶剂里达到 饱和 状态时所溶解的质量为该物质在这种溶剂里的溶解度。溶解度数值越大,表明该温度下,物质的溶解能力
越强 。如20℃时食盐的溶解度是36克,就表示在 20℃ 时, 100克 水中最多(即达到
饱和 状态)能溶解食盐 36克 。
在 一定温度 下,某(固体)物质在 100 克溶剂里达到 饱和 状态时所溶解的质量为该物质在这种溶剂里的溶解度。溶解度数值越大,表明该温度下,物质的溶解能力
越强 。如20℃时食盐的溶解度是36克,就表示在 20℃ 时, 100克 水中最多(即达到
饱和 状态)能溶解食盐 36克 。


 2.对固体溶解度涵义理解时,应注意以下几点:
2.对固体溶解度涵义理解时,应注意以下几点:


 (1)要强调在一定的温度下,因为 温度变化对溶解度大小有一定影响;
(1)要强调在一定的温度下,因为 温度变化对溶解度大小有一定影响;


 (2)各种固体物质的溶解度需要对溶剂量制定一个统一的标准,涵义中以 100克溶剂 作为标准;
(2)各种固体物质的溶解度需要对溶剂量制定一个统一的标准,涵义中以 100克溶剂 作为标准;


 (3)因为每一种溶质,在一定量溶剂里达到饱和和不饱和状态时溶解溶质的量是不同的,所以应规定 达到饱和
状态;
(3)因为每一种溶质,在一定量溶剂里达到饱和和不饱和状态时溶解溶质的量是不同的,所以应规定 达到饱和
状态;


 (4)这里指的质量用 克 作单位,与溶剂单位一致。
(4)这里指的质量用 克 作单位,与溶剂单位一致。


 3.溶解性等级的划分。
3.溶解性等级的划分。


 (1)溶解性等级的划分依据: 室温(20℃)时的溶解度 。
(1)溶解性等级的划分依据: 室温(20℃)时的溶解度 。


 (2)等级的划分。
(2)等级的划分。
溶解性   等级 等级 |
易溶   |
可溶   |
微溶   |
难溶   |
|
溶解度 |
>10克 |
1-10克 |
0.01-1克 |
<0.01克 |
|
举例 |
食盐   硝酸钾 硝酸钾 |
氯酸钾 |
氢氧化钙 |
碳酸钙 |


 (3)溶解性等级的划分是相对的。
(3)溶解性等级的划分是相对的。


 三、探究影响固体溶解度大小的因素(以硝酸钾为例)
三、探究影响固体溶解度大小的因素(以硝酸钾为例)


 1.提出探究的问题: 影响硝酸钾溶解度大小的因素有哪些?(等)
1.提出探究的问题: 影响硝酸钾溶解度大小的因素有哪些?(等)


 2.建立假设: 温度可能是影响硝酸钾溶解度大小的因素(等) 。
2.建立假设: 温度可能是影响硝酸钾溶解度大小的因素(等) 。


 3.设计实验:
3.设计实验:


 (1)在室温下配制硝酸钾的饱和溶液;
(1)在室温下配制硝酸钾的饱和溶液;


 (2)给饱和溶液加热后再加入硝酸钾,现象: 硝酸钾又溶解了 ,一直加到硝酸钾不能再溶解为止;
(2)给饱和溶液加热后再加入硝酸钾,现象: 硝酸钾又溶解了 ,一直加到硝酸钾不能再溶解为止;


 (3)将上述饱和溶液冷却到室温,现象: 有较多的硝酸钾固体析出 。
(3)将上述饱和溶液冷却到室温,现象: 有较多的硝酸钾固体析出 。


 4.得出结论: 硝酸钾的溶解度随温度升高而增大,随温度的降低而减小,温度是影响硝酸钾溶解度大小的因素 。
4.得出结论: 硝酸钾的溶解度随温度升高而增大,随温度的降低而减小,温度是影响硝酸钾溶解度大小的因素 。


 5.合作交流。
5.合作交流。


 四、溶解度曲线
四、溶解度曲线


 1.通过实验测出物质在各个不同温度的溶解度,运用数学方法可以绘制出溶解度曲线。溶解度曲线表示以下几方面的意义:
1.通过实验测出物质在各个不同温度的溶解度,运用数学方法可以绘制出溶解度曲线。溶解度曲线表示以下几方面的意义:


 (1)曲线上每个点表示某温度下某溶质的 溶解度 ;
(1)曲线上每个点表示某温度下某溶质的 溶解度 ;


 (2)溶解度曲线表示同一物质在不同温度时的不同 溶解度 数值;
(2)溶解度曲线表示同一物质在不同温度时的不同 溶解度 数值;


 (3)曲线表示不同物质在同一温度时的 溶解度 数值;
(3)曲线表示不同物质在同一温度时的 溶解度 数值;


 (4)曲线表示物质的溶解度受 温度 变化影响大小的情况;
(4)曲线表示物质的溶解度受 温度 变化影响大小的情况;


 (5)两条曲线的交点,表示在该 温度 下两种物质的 溶解度 相等;
(5)两条曲线的交点,表示在该 温度 下两种物质的 溶解度 相等;


 (6)曲线上每个点所配制的溶液是该温度下这种溶质的 饱和
溶液,曲线下方的点表示对应温度下该溶质的 不饱和
溶液。
(6)曲线上每个点所配制的溶液是该温度下这种溶质的 饱和
溶液,曲线下方的点表示对应温度下该溶质的 不饱和
溶液。


 2.从p.35固体物质溶解度曲线图中可以看出:
2.从p.35固体物质溶解度曲线图中可以看出:


 (1)大多数固体物质的溶解度,随温度升高而增大,如 硝酸钾 ;
(1)大多数固体物质的溶解度,随温度升高而增大,如 硝酸钾 ;


 (2)少数固体物质的溶解度,受温度影响不大,如 氯化钠 ;
(2)少数固体物质的溶解度,受温度影响不大,如 氯化钠 ;


 (3)极少数固体物质的溶解度,随温度升高而减小,如 氢氧化钙 。
(3)极少数固体物质的溶解度,随温度升高而减小,如 氢氧化钙 。


 [课内练习]
[课内练习]


 1.下列说法对不对?为什么?
1.下列说法对不对?为什么?


 (1)100克水中最多溶解36克氯化钠,所以氯化钠在水中的溶解度是36克;
(1)100克水中最多溶解36克氯化钠,所以氯化钠在水中的溶解度是36克;


 (2)50℃时,烧杯中的水最多溶有30克氯化钠,所以氯化钠在水中的溶解度是30克;
(2)50℃时,烧杯中的水最多溶有30克氯化钠,所以氯化钠在水中的溶解度是30克;


 (3)在60℃时,100克水中溶有75克硝酸钾,所以60℃时硝酸钾的溶解度为75克;
(3)在60℃时,100克水中溶有75克硝酸钾,所以60℃时硝酸钾的溶解度为75克;


 (4)60℃时,100克水中最多溶解110克硝酸钾,所以硝酸钾在这温度下的溶解度是110。
(4)60℃时,100克水中最多溶解110克硝酸钾,所以硝酸钾在这温度下的溶解度是110。


 [答] 以上四种说法都是错误的,因为在每种描述中都忽略了溶解度概念中的某一要素。(1)中忽略了在一定的温度下这一条件;(2)中忽略了应在100克溶剂即一定量溶剂这一条件;(3)中忽略了溶液应达到饱和状态这一条件;(4)中忽略了固体溶解度的单位这一条件。
[答] 以上四种说法都是错误的,因为在每种描述中都忽略了溶解度概念中的某一要素。(1)中忽略了在一定的温度下这一条件;(2)中忽略了应在100克溶剂即一定量溶剂这一条件;(3)中忽略了溶液应达到饱和状态这一条件;(4)中忽略了固体溶解度的单位这一条件。


 2.对照书本p.3;图1-68、图1-69,完成下列问题:
2.对照书本p.3;图1-68、图1-69,完成下列问题:


 (1)0℃时,硝酸铵的溶解度为 120 克;
(1)0℃时,硝酸铵的溶解度为 120 克;


 (2)20℃时,①氯化钠;②硝酸钾;③硝酸钠;④硝酸铵四种固体的溶解度由大到小的顺序是 ④>③>①>② ;(填编号)
(2)20℃时,①氯化钠;②硝酸钾;③硝酸钠;④硝酸铵四种固体的溶解度由大到小的顺序是 ④>③>①>② ;(填编号)


 (3)硝酸钠与硝酸钾在 80 ℃时溶解度相同;
(3)硝酸钠与硝酸钾在 80 ℃时溶解度相同;


 (4) 氢氧化钙 的溶解度随温度的升高而减小;
(4) 氢氧化钙 的溶解度随温度的升高而减小;


 (5)在60℃时,100克水中分别加入60克硝酸钾和氯化钾固体, 硝酸钾
得到的是不饱和溶液,在此温度下,还需再加入 50 克固体才饱和,而 氯化钾 得到的是饱和溶液。
(5)在60℃时,100克水中分别加入60克硝酸钾和氯化钾固体, 硝酸钾
得到的是不饱和溶液,在此温度下,还需再加入 50 克固体才饱和,而 氯化钾 得到的是饱和溶液。


 [课时小结]
[课时小结]


 重点:1.物质的溶解性。
重点:1.物质的溶解性。


 2.固体物质的溶解度。
2.固体物质的溶解度。


 3.溶解性与溶解度的关系。
3.溶解性与溶解度的关系。


 4.影响固体溶解度的因素。
4.影响固体溶解度的因素。


 5.溶解度曲线的理解。
5.溶解度曲线的理解。


 难点:1.固体溶解度的概念。
难点:1.固体溶解度的概念。


 2.溶解度曲线。
2.溶解度曲线。


 课外同步训练
课外同步训练


 [基础过关]
[基础过关]


 1.20℃时硝酸钾的溶解度是31.6克,这表示 20℃时100克水中最多能够溶解硝酸钾
1.20℃时硝酸钾的溶解度是31.6克,这表示 20℃时100克水中最多能够溶解硝酸钾


 31.6克
。
31.6克
。


 2,20℃时,在100克水中最多能溶解5克某固体物质,该物质的溶解性等级应是( B
)
2,20℃时,在100克水中最多能溶解5克某固体物质,该物质的溶解性等级应是( B
)


 A.易溶 B.可溶 C.微溶 D.难溶
A.易溶 B.可溶 C.微溶 D.难溶


 3.10℃时硝酸铵的溶解度是140克,若将100克硝酸铵放到100克水中充分溶解后,能得到 不饱和 的硝酸铵溶液,还需加入 40 克 硝酸铵
才能刚好成为10℃时的硝酸铵饱和溶液。
3.10℃时硝酸铵的溶解度是140克,若将100克硝酸铵放到100克水中充分溶解后,能得到 不饱和 的硝酸铵溶液,还需加入 40 克 硝酸铵
才能刚好成为10℃时的硝酸铵饱和溶液。


 4.20℃时A物质的溶解度为20克,40℃时B物质的溶解度为40克,则30℃时,A、B物质的溶解度大小关系是 ( D
)
4.20℃时A物质的溶解度为20克,40℃时B物质的溶解度为40克,则30℃时,A、B物质的溶解度大小关系是 ( D
)


 A.A大 B.B大 C. A、B一样大 D.无法判断
A.A大 B.B大 C. A、B一样大 D.无法判断


 [深化提高]
[深化提高]


 5.如何使一瓶接近饱和的氢氧化钙溶液变成饱和溶液?
5.如何使一瓶接近饱和的氢氧化钙溶液变成饱和溶液?


 [答] 可以采用以下三种方法使其成为饱和溶液:
[答] 可以采用以下三种方法使其成为饱和溶液:


 (1)加少量溶质氢氧化钙粉末;
(1)加少量溶质氢氧化钙粉末;


 (2)恒温下蒸发部分溶剂水;
(2)恒温下蒸发部分溶剂水;


 (3)升高温度(因它的溶解度随温度升高反而减小)。
(3)升高温度(因它的溶解度随温度升高反而减小)。


 6.根据图1-36所示的物质溶解度曲线图,回答以下问题:
6.根据图1-36所示的物质溶解度曲线图,回答以下问题:



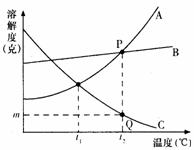


 (1)当温度高于t2℃时,A、B、C三种物质溶解度由小到大的顺序是
C<B<A ;
(1)当温度高于t2℃时,A、B、C三种物质溶解度由小到大的顺序是
C<B<A ;


 (2)P点表示 在t2℃A、B两种物质的溶解度相等 ;
(2)P点表示 在t2℃A、B两种物质的溶解度相等 ;


 (3)A、B、C的溶解度为B>A>C的温度范围是 t1<t<t2 ;
(3)A、B、C的溶解度为B>A>C的温度范围是 t1<t<t2 ;


 (4)Q点表示t2℃时在 100 克水中已溶解A物质 m
克,此时的溶液是A物质的
(4)Q点表示t2℃时在 100 克水中已溶解A物质 m
克,此时的溶液是A物质的


 不饱和 溶液。
不饱和 溶液。


 第15课时
第15课时
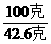 =
=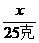
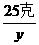
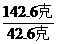 =
=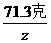
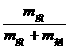
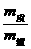 =
=
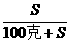 或S=
或S=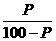 ×100克
×100克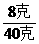 =0.2或20%
=0.2或20%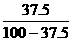 ×100克=60克
×100克=60克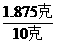 =18.75%
=18.75%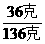 =26.5%,即20℃时最浓的食盐溶液只能是26.5%,所以20℃时是不可能配制成36%的食盐溶液的。
=26.5%,即20℃时最浓的食盐溶液只能是26.5%,所以20℃时是不可能配制成36%的食盐溶液的。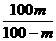 B.
B.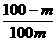 克 D.
克 D.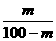 克
克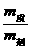 ×100克=
×100克=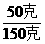 ×100克=33.3克
×100克=33.3克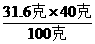 =12.6克
=12.6克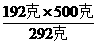 =329克
=329克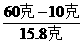 =
=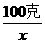
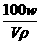 克 B.
克 B.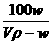 克 C.
克 C. 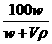 克 D.
克 D.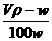 克
克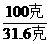 =
=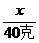
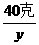
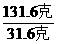 =
=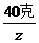
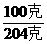 =
=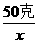
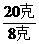 =
=
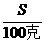 或
或