网址:http://m.1010jiajiao.com/timu3_id_3978291[举报]

⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 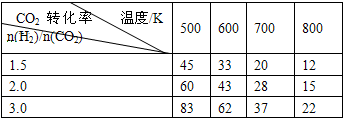
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。

⑴下列能使醋酸溶液中CH3COOH的电离度增大,而电离常数不变的操作是_______(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸
⑵CH3COONH4的水溶液呈______(选填“酸性”、“中性”、“碱性”),理由是____________________。
⑶工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使c(SO42- )达到0.0l mol/L以上,则溶液中c(CO32- )应≥_______ mol/L。
Ⅱ.化学在能源开发与利用中起着重要的作用,如甲醇、乙醇、二甲醚(CH3OCH3)等都是新型燃料。
⑴乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2O(g) △H=a kJ/mol 在一定压强下,测得上述反应的实验数据如下表。 
①上述反应的 a_______0(填“大于”或“小于”)。
②在一定温度下,提高氢碳(即n(H2)/n(CO2) )比,平衡常数K值_______(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
⑵催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

②在一定温度下,向上述密闭容器中加入1 mol CO、3 mol H2及固体催化剂,使之反应。平衡时,反应产生的热量为Q kJ,若温度不变的条件下,向上述密闭容器中加入4 mol CO、
12 mol H2及固体催化剂,平衡时,反应产生的热量为w kJ,则w的范围为___________。
⑶二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是_________________。
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。

(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10—1mol) |
4.3 |
5.9 |
6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq)
+2NH3·H2O(aq)
Mg2+(aq)
+2NH3·H2O(aq)
写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
|
实验① |
等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 |
生成白色沉淀 |
|
实验② |
等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 |
无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq) = IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
|
实验编号 |
I—的初始浓度 (mol·L—1) |
ClO—的初始浓度 (mol·L—1) |
OH—的初始浓度 (mol·L—1) |
初始速率v (mol·L—1· s—1) |
|
1 |
2 × 10—3 |
1.5 × 10—3 |
1.00 |
1.8 × 10—4 |
|
2 |
a |
1.5 × 10—3 |
1.00 |
3.6 × 10—4 |
|
3 |
2 × 10—3 |
3 × 10—3 |
2.00 |
1.8 × 10—4 |
|
4 |
4 × 10—3 |
3 × 10—3 |
1.00 |
7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v= k [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
查看习题详情和答案>>
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。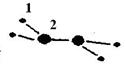
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) 写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。 查看习题详情和答案>>
以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:


氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)写出制备 NH4Cl的化学方程式: 。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
 (3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;若用普通的漏斗,贴上滤纸后,接上抽滤瓶进行吸滤则不行,因为 。
(3)实验过程中趁热过滤的目的是 。趁热过滤可采用抽滤装置,抽滤装置如图1所示,该装置中的错误之处是 ;若用普通的漏斗,贴上滤纸后,接上抽滤瓶进行吸滤则不行,因为 。
![]() (布氏漏斗的使用:一般先在圆筒底面垫上滤纸,将布氏漏斗插进抽滤瓶并将接口密封。抽滤瓶的侧口连抽气系统。然后将欲分离的固体、液体混合物倒进上方,液体成分在负压力作用下被抽进抽滤瓶中,固体留在上方。)
(布氏漏斗的使用:一般先在圆筒底面垫上滤纸,将布氏漏斗插进抽滤瓶并将接口密封。抽滤瓶的侧口连抽气系统。然后将欲分离的固体、液体混合物倒进上方,液体成分在负压力作用下被抽进抽滤瓶中,固体留在上方。)

图1 图2
(4)趁热过滤后,滤液冷却结晶。一般情况下,下列哪些因素有利于得到较大的晶体____。
A.缓慢冷却溶液 B.溶液浓度较高 C.溶质溶解度较小 D.缓慢蒸发溶剂
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 ___。某研究性学习小组为测定该NH4Cl产品中氮的含量,设计了如图2装置,并进行了讨论。
甲同学:根据此实验测得的数据,计算的NH4Cl产品的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:__ ____。
乙同学:实验过程中,往烧瓶中加入的浓氢氧化钠溶液一定要足量并充分加热,原因是 。
用改进后的实验装置重新进行实验,称取13.5gNH4Cl产品,测得实验后B装置增重3.4g。则该化肥含氮量为 。
查看习题详情和答案>>