摘要:根据上述关系式.可以进行有关溶解度的计算.但计算时还应注意格式的规范化. [典型例题解析] [例1] 10℃时.将50克氯化铵溶于水.正好制成200克饱和溶液.求此温度下氯化铵的溶解度. [解析] 根据题中已知条件可知:m质=50克.m液=200克 所以m剂=m液-m质=200克-50克=150克 根据公式可以计算:S=×100克=×100克=33.3克 [答] 略 [例2] 已知20℃时硝酸钾的溶解度是31.6克.求此温度下的40克水溶解多少克硝酸 钾才能得到饱和溶液. [解析] 20℃时.100克水可溶解硝酸钾31.6克.设20℃时40克水中最多可溶解硝酸钾的质量为x.那么: 100克:31.6克=40克:x x= =12.6克 [答] 略 [例3] 20℃时.硝酸铵的溶解度是192克.现要配制此温度下的硝酸铵饱和溶液500 克.需要硝酸铵和水各多少克? [解析] 由溶解度定义可知.20℃时192克硝酸铵溶于100克水中.可得到292克硝酸铵饱和溶液. 设500克硝酸铵饱和溶液中含硝酸铵质量为x.则 292克:192克=500克:x x= =329克 所以需要水的质量为500克-329克=171克 [答] 略 [例4] 20℃时.氯化钠的溶解度为36克.现有20℃时100克氯化钠溶液.其中已溶解氯化钠20克.问此溶液是否饱和?如果不饱和.可以采取什么方法使其成为20℃时的饱和溶液? [解析] 从题中所给条件可知.20℃时100克氯化钠溶液中已溶解氯化钠20克.则含有溶剂水80克.设20℃时80克水中达到饱和状态最多可溶解氯化钠的质量为x 则100克:36克=80克:x. 解得x=28.8克 所以可以判断原溶液为20℃时的不饱和溶液.要使其成为20℃时的饱和溶液.具体方法有: (1)加溶质氯化钠.则应再加氯化钠28.8克-20克=8.8克, (2)蒸发溶剂.设应蒸发水的质量为y 则36克:100克=20克: 解得y=24.4克 即应蒸发水24.4克.才能刚好成为20℃时的饱和溶液 [答] 略 [课内练习] 1.60℃时.硝酸钾的溶解度为110克.回答下列问题: (1)60℃时.把30克硝酸钾加到50克水里.能得到 80 克硝酸钾的 不饱和 溶液, (2)60℃时.把30克硝酸钾加到20克水里.能得到 42 克硝酸钾的 饱和 溶液, (3)60℃时.84克硝酸钾饱和溶液里含有 40 克水和 44 克硝酸钾. 2.50℃时氯化铵的溶解度是50克.50℃时氯化铵饱和溶液中溶质.溶剂和溶液之间的质量比为 A.1:2:3 B.2:3:1 C.3:2:1 D.1:3:2 3.将15.8克硝酸钾加到60克水中全部溶解.若在20℃时.恒温蒸发10克水后溶液恰好饱和.则20℃硝酸钾的溶解度是多少? [解] 设20℃时硝酸钾的溶解度为x.则= x=31.6克 [课时小结] 重点和难点:学会溶解度的有关计算. 课外同步训练 [基础过关). 1.20℃时.将9克食盐溶于25克水中.刚好制得饱和溶液34克.则20℃时食盐的溶解度为 A.36 B.36克 C.26.5 D.26.5克 2.20℃时.某物质的饱和溶液中.溶质和溶液的质量比为2:7.则20℃时该物质的溶解度为 A.28.6克 B.28.6% C.40克 D.40% 3.在20℃时.将某物质w克完全溶解.制成V毫升饱和溶液.若饱和溶液的密度为ρ克/厘米3.则该物质在20℃时的溶解度为 A.克 B.克 C. 克 D.克 4.在20℃时.下列四种物质分别溶解在水里.恰好制成饱和溶液.溶解度最大的是 A.3克物质溶解在30克水里 B.100克溶液中含有溶质20克 C.溶质和溶剂的质量比为1:2的溶液 D.1.2克物质溶解在1.5克水里 5.20℃时硝酸钾的溶解度为31.6克.要配制20℃的硝酸钾饱和溶液.计算: (1)40克硝酸钾应溶解在多少克水中刚好饱和? (2)40克水里最多能溶解硝酸钾多少? (3)配制40克硝酸钾饱和溶液需硝酸钾和水各多少? [解] (1) = x=126.6克 (2) = y=12.64克 (3)设需硝酸钾的质量为z = z=9.6克 需水40克-9.6克=30.4克 6.在20℃时.蔗糖的溶解度是204克.现有20℃时蔗糖溶液100克.其中已溶解蔗糖50克.问此溶液在20℃时是否饱和?若不饱和.应再加多少克蔗糖才能饱和? [解] = x=102克 因为102克>50克. 所以不饱和 应再加蔗糖102克-50克=52克 [深化提高] 7.20℃时.A物质的不饱和溶液100克.要使其成为20℃的饱和溶液.可以恒温蒸发20克水或加入8克溶质.求20℃时A物质的溶解度. [解] 本题可以思考第一种方法中恒温下蒸发20克水即剩下80克饱和溶液.第二种方法中加入的8克溶质溶解在第一份蒸发出来的水中刚好应该成为饱和溶液.这样易求解.易分析. 设20℃时A物质的溶解度为x = x=40克 第16课时
网址:http://m.1010jiajiao.com/timu3_id_3978287[举报]
(2012?丹阳市二模)某校兴趣小组中的甲、乙两位同学进行了制取氢氧化铜的实验.
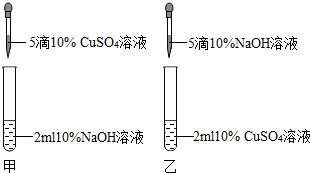
[实验现象]甲同学得到了蓝色沉淀,乙同学得到了浅绿色沉淀.
[实验讨论]甲同学得到的蓝色沉淀一定是氢氧化铜,请写出反应的化学方程式为_
[查阅资料]氢氧化钠与硫酸铜反应可能会生成碱式硫酸铜,它是浅绿色、受热会分解、不溶于水但能溶于酸的物质,在酸性溶液中可发生反应生成Cu2+、S042-和水.
[拓展探究]甲、乙两位同学对碱式硫酸铜产生了兴趣,分别进行了下列实验.
[实验设计]甲同学:证明该浅绿色沉淀中含有硫酸根
(1)将浅绿色的浊液过滤,并把得到的浅绿色沉淀用蒸馏水多次洗涤;
(2)取最后一次洗涤液,加入
(3)把绿色沉淀转移到试管中,加入足量的
乙同学:探究碱式硫酸铜受热分解的产物--取适量碱式硫酸铜加入试管中充分进行加热,并把生成的气体依次通过B、C、D装置.
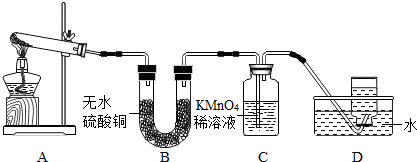
现象与结论:A中残留有黑色固体,取样加入足量的稀硫酸中,溶液变成
B中无水硫酸铜变成蓝色,说明生成了
C中KMnO4稀溶液褪色,说明生成了
等D中集气瓶内气体收满后,正放在桌上,乙同学用
[深入探究]确定此次得到的浅绿色沉淀的组成
[查阅资料](1)碱式硫酸铜其有多种可能的组成,如:Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.
(2)碱式硫酸铜可表示为:aCu(OH)2?bCuSO4.已知Cu(OH)2的分解温度为66℃∽68℃,生成对应的两种氧化物;而CuSO4的分解温度为600℃以上.
[实验讨论]同学们用热分析仪对该浅绿色沉淀进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图.
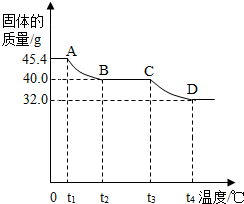
请根据图示回答下列问题:
①0~t1段内固体质量不变的原因是
②A B、C D段固体质量减轻,请写出导致固体质量减轻的生成物的化学式:
AB段:
CD段:
③通过计算可得:该碱式硫酸铜的化学式是
[实验结论](1)乙同学实验中NaOH溶液与CuSO4溶液反应生成上述碱式硫酸铜的化学方程式为
(2)当NaOH溶液与CuSO4溶液反应时,只有控制CuSO4的量一定,NaOH
(3)当反应物的量不同,产物可能不同,试另举一例:
查看习题详情和答案>>

[实验现象]甲同学得到了蓝色沉淀,乙同学得到了浅绿色沉淀.
[实验讨论]甲同学得到的蓝色沉淀一定是氢氧化铜,请写出反应的化学方程式为_
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
.那么乙同学得到的浅绿色沉淀是什么呢?[查阅资料]氢氧化钠与硫酸铜反应可能会生成碱式硫酸铜,它是浅绿色、受热会分解、不溶于水但能溶于酸的物质,在酸性溶液中可发生反应生成Cu2+、S042-和水.
[拓展探究]甲、乙两位同学对碱式硫酸铜产生了兴趣,分别进行了下列实验.
[实验设计]甲同学:证明该浅绿色沉淀中含有硫酸根
(1)将浅绿色的浊液过滤,并把得到的浅绿色沉淀用蒸馏水多次洗涤;
(2)取最后一次洗涤液,加入
BaCl2
BaCl2
溶液,没有白色沉淀产生,说明沉淀已洗净;(3)把绿色沉淀转移到试管中,加入足量的
稀盐酸
稀盐酸
溶液使沉淀完全溶解,再加入氯化钡溶液,有大量白色沉淀生成,表示浅绿色沉淀中有S042-.乙同学:探究碱式硫酸铜受热分解的产物--取适量碱式硫酸铜加入试管中充分进行加热,并把生成的气体依次通过B、C、D装置.

现象与结论:A中残留有黑色固体,取样加入足量的稀硫酸中,溶液变成
蓝色
蓝色
色且无其它明显现象,说明该黑色固体是CuO;B中无水硫酸铜变成蓝色,说明生成了
水
水
;C中KMnO4稀溶液褪色,说明生成了
SO2
SO2
;等D中集气瓶内气体收满后,正放在桌上,乙同学用
带火星的木条
带火星的木条
证明生成了O2.[深入探究]确定此次得到的浅绿色沉淀的组成
[查阅资料](1)碱式硫酸铜其有多种可能的组成,如:Cu2(OH)2SO4、Cu3(OH)4SO4或Cu4(OH)6SO4等.
(2)碱式硫酸铜可表示为:aCu(OH)2?bCuSO4.已知Cu(OH)2的分解温度为66℃∽68℃,生成对应的两种氧化物;而CuSO4的分解温度为600℃以上.
[实验讨论]同学们用热分析仪对该浅绿色沉淀进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图.

请根据图示回答下列问题:
①0~t1段内固体质量不变的原因是
没有达到反应所需的温度
没有达到反应所需的温度
.②A B、C D段固体质量减轻,请写出导致固体质量减轻的生成物的化学式:
AB段:
H2O
H2O
;CD段:
O2、SO2
O2、SO2
;③通过计算可得:该碱式硫酸铜的化学式是
Cu4(OH)6SO4
Cu4(OH)6SO4
;[实验结论](1)乙同学实验中NaOH溶液与CuSO4溶液反应生成上述碱式硫酸铜的化学方程式为
6NaOH+4CuSO4=Cu4(OH)6SO4↓+3Na2SO4.
6NaOH+4CuSO4=Cu4(OH)6SO4↓+3Na2SO4.
.(2)当NaOH溶液与CuSO4溶液反应时,只有控制CuSO4的量一定,NaOH
过量
过量
(填“过量”或“不足”)时才能生成蓝色沉淀.(3)当反应物的量不同,产物可能不同,试另举一例:
木炭燃烧,氧气不足时生成CO,氧气充足时生成CO2.
木炭燃烧,氧气不足时生成CO,氧气充足时生成CO2.
.叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
[查阅资料]
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
[问题探究]
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式:______.
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示):______.
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置.

①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是______.
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用______;若无装置C,对测定结果造成的影响是______(填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为______(填字母序号,可重复).
(4)该小组对某一工业级NaN3样品进行检测.取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡.
首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4;
然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示.

①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线.
②计算该样品中纯碱的质量分数.
查看习题详情和答案>>
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究.
[查阅资料]
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
[问题探究]
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式: .
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示): .
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置.
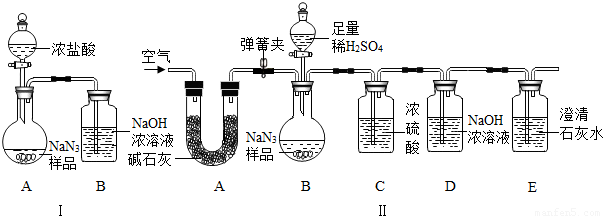
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 .
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用 ;若无装置C,对测定结果造成的影响是 (填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为 (填字母序号,可重复).
(4)该小组对某一工业级NaN3样品进行检测.取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡.
首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4;
然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示.

①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线.
②计算该样品中纯碱的质量分数. 查看习题详情和答案>>
[查阅资料]
①NaN3受撞击会生成Na、N2.
②NaN3遇盐酸、H2SO4溶液无气体生成.
③碱石灰是CaO和 NaOH的混合物.
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3).
[问题探究]
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式: .
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示): .
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置.

①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 .
②小刚同学在大家讨论的基础上,设计了装置II.请分析:装置II中A的作用 ;若无装置C,对测定结果造成的影响是 (填“偏大”、“偏小”或“无影响”);
③根据装置II,小组同学设计的实验步骤有:
a.称量装置D.
b.称量样品,检查装置气密性.
c.打开弹簧夹,鼓入空气.
d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞.
其正确顺序为 (填字母序号,可重复).
(4)该小组对某一工业级NaN3样品进行检测.取100克该样品于烧杯中,加水将其溶解,然后逐滴加入一定溶质质量分数的稀硫酸并不断振荡.
首先发生的反应是:2Na2CO3+H2SO4=2NaHCO3+Na2SO4;
然后发生的反应是:2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑;
在上述过程中生成二氧化碳的质量与加入稀硫酸质量的关系如图甲所示.

①请你根据以上信息,在图乙的坐标系中画出检测过程中烧杯中溶液的质量随滴加硫酸溶液质量的变化曲线.
②计算该样品中纯碱的质量分数. 查看习题详情和答案>>
在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆).某化学兴趣小组提出可以用含铜废料制备胆矾(CuSO4?XH2O).
查阅资料:(1)过氧化氢在常温下会缓慢分解为氧气和水.对其水溶液加热、光照或加催化剂(如MnO2 )都会促进其分解.
(2)CuSO4?XH2O可溶于水,在加热时会生成CuSO4和H2O.
I、硫酸铜的制备
方案1:甲同学根据已学知识,提出了制备硫酸铜方案:
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:
(1)写出上述方案中的②处铜或铜的化合物有关的化学反应方程式是:______.
(2)从环保角度对两套方案的不同部分进行比较,你认为方案______(填1或2)更合理.理由是:______.
(3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的可能的原因为______.
(4)若上述方案所用的稀硫酸是在实验室中由稀释浓硫酸得到,在稀释浓硫酸时的操作是:______
______.
(5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体.晶体采用酒精淋洗的优点是______.
II、硫酸铜晶体(CuSO4?xH2O)中结晶水(xH2O)含量的测定学习小组取12.5g硫酸铜晶体(CuSO4?xH2O)进行热分解,
获得相关数据,并绘制成固体质量一温度的关系如图.
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为______色,最终变为黑色;
(2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为______;
(3)根据图中数据,计算CuSO4?xH2O中x的值为______.(请写出计算过程)
(4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出剩余固体的化学式:______.
Ⅲ、硫酸铜的应用
波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为______.碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3?Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为______,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是______(填一种有机物名称).
查看习题详情和答案>>
地球是一颗蓝色的星球,表面大部分被海洋覆盖,海水中蕴含的元素多达80多种.同学们在学习过程中对海水中的宝藏产生了浓厚的兴趣,进行了如下探究:
(探究一)小亮对晒盐后的苦卤进行探究
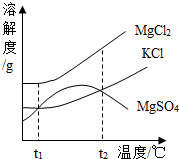
(1)海水晒制后得到的晶体是粗盐,剩余的液体称为苦卤,右图是苦卤中有关物质的溶解度曲线,已知t1℃时,氯化镁和氯化钾的溶解度分别为M、N,则它们溶解度大小的关系为 ;将苦卤加热到t2℃以上(溶剂量不变),根据溶解度曲线,有可能析出晶体的应是 .
(2)化工厂利用苦卤生产镁的流程如下: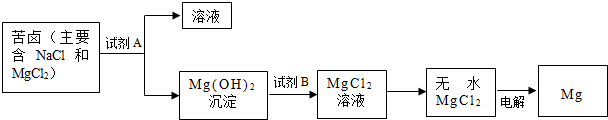
试剂A最好选用 (从有丰富的石灰石资源考虑),试剂B选用 ,氯化镁电解后还生成一种双原子分子气体单质,电解反应的化学方程式为 .
(探究二)小芳用提纯得到的氯化钠进行溶液的配制
她想配制100g 0.9% 的医用生理盐水,可能涉及以下操作:①称量②过滤③计算④蒸发结晶 ⑤溶解.
(1)操作的正确顺序是 (填序号).
(2)配制上述溶液需要水的体积是 mL(水的密度是l g/cm3).需用到的玻璃仪器是烧杯、量筒和 .实验室有10mL、50mL、100mL三种不同规格的量筒,配制上述溶液时最好选用 mL的量筒,如在称量氯化钠固体过程中,发现天平指针向左偏,此时应进行的操作是 .
查看习题详情和答案>>
(探究一)小亮对晒盐后的苦卤进行探究

(1)海水晒制后得到的晶体是粗盐,剩余的液体称为苦卤,右图是苦卤中有关物质的溶解度曲线,已知t1℃时,氯化镁和氯化钾的溶解度分别为M、N,则它们溶解度大小的关系为
(2)化工厂利用苦卤生产镁的流程如下:

试剂A最好选用
(探究二)小芳用提纯得到的氯化钠进行溶液的配制
她想配制100g 0.9% 的医用生理盐水,可能涉及以下操作:①称量②过滤③计算④蒸发结晶 ⑤溶解.
(1)操作的正确顺序是
(2)配制上述溶液需要水的体积是