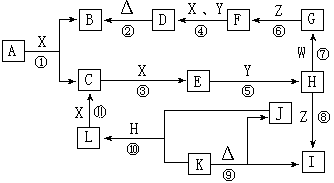
20.(12分)铜在自然界存在于多种矿石中,如:
|
矿石名称 |
黄铜矿 |
斑铜矿 |
辉铜矿 |
孔雀石 |
|
主要成分 |
CuFeS2 |
Cu5FeS4 |
Cu2S |
CuCO3·Cu(OH)2 |
请回答下列问题:
(1)上表所列铜化合物中,铜的质量百分含量最高的是 。
(2)工业上以黄铜矿为原料。采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是 。
6Cu+SO2↑,反应的氧化剂是 。
(3)SO2尾气直接排放到大气中造成环境污染的后果是 ;处理该尾气可得到有价值的化学品,写出其中1种酸和1种盐的名称 。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。请简述粗铜电解得到精铜的原理: 。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 (填字母)。
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
判断 |
|
A |
铜绿的主成分是碱酸铜 |
可用稀盐酸除铜器表面的铜绿 |
Ⅰ对;Ⅱ 对;有 |
|
B |
铜表易形成致密的氧化膜 |
铜容器可以盛放浓硫酸 |
Ⅰ对;Ⅱ 对;有 |
|
C |
铁比铜活泼 |
例在铜板上的铁钉在潮湿空气中不易生锈 |
Ⅰ对;Ⅱ 对;有 |
|
D |
蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 |
硫酸铜溶液可用作游泳池的消毒剂 |
Ⅰ错;Ⅱ 对;无 |
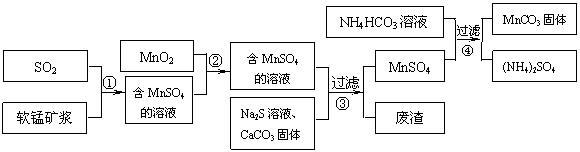
16.(8分)碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。一种制备MnCO3的生产流程如下图所示。
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
|
物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
|
开始沉淀pH |
2.7 |
7.6 |
8.3 |
|
完全沉淀pH |
3.7 |
9.6 |
9.8 |
|
物质 |
MnS |
CuS |
PbS |
|
Ksp |
2.5×10-13 |
6.3×10-36 |
8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气。流程①中主要发生的反应有:MnO2 + SO2 = MnSO4 2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+。
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH (填“大”或“小”),该流程可与 (填工业生产名称)联合,生产效益更高。
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为 ,这样设计的目的和原理是
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是 。
(4)反应④发生的化学反应为:MnSO4 + 2NH4HCO3 = MnCO3↓+ (NH4)2SO4 + CO2↑ + H2O。
反应中通常需加入稍过量的NH4HCO3 ,且控制溶液的pH为6.8-7.4。加入稍过量的NH4HCO3的目的是 ,溶液的pH不能过低的原因是 。
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应
工艺B:软锰矿与煤碳粉混合,焙烧后加稀硫酸溶解。
其中工艺A的优点是 。(答对1个即可)
 >
> >
>


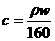 B.
B.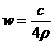 C.
C.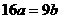 D.
D.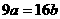
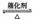 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数) 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2