26.下面是某学习小组的同学进行研究性学习的过程。
[研究课题]: 探究草酸晶体受热分解的产物。
[查阅资料]: 该小组同学通过查询,获得草酸及草酸晶体的相关知识:
|
名称 |
化学式 |
颜色、状态 |
溶解性 |
熔点(℃) |
密度(g/cm3) |
|
草酸 |
H2C2O4 |
- |
易溶于水 |
189.5 |
1.900 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
1.650 |
备注:草酸晶体175℃以上开始分解。
[提出猜想]:请根据草酸晶体的组成对分解可能生成的产物进行猜想。
⑴ ;
⑵分解产物中的气体可能是CO、CO2或它们的混合物。
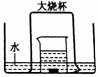
[设计方案]①为验证“猜想⑴”,请在方框内画出实验设计装置图,并标明所需药品:

②该小组利用下图装置继续进行“猜想⑵”的探究。A、C、F中盛澄清石灰水,B中盛浓NaOH溶液,D中装碱石灰(CaO、NaOH固体混合物),E中装CuO粉末。
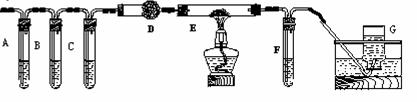
①证明草酸晶体分解产物中有CO2的现象: ;
证明分解产物中有CO的现象: 。
②若未连接G,要达到同样目的,可采取的措施: 。
[交流讨论]:小李同学查阅资料发现:草酸是二元弱酸,但比碳酸强,受热分解时有少量升华,草酸钙和草酸氢钙均为白色不溶物,因此对实验中CO2的检验提出质疑,试根据信息,指出原设计的存在的问题,并提出改进措 。
25.(10分)乙醛是重要的化工原料。目前工业上使用两种方法制取乙醛:
(1) 乙炔水化法: CH≡CH+H2O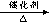 CH3CHO
;
CH3CHO
;
(2) 乙烯氧化法 :CH2=CH2 + O2 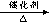 CH3CHO 有关信息为:
CH3CHO 有关信息为:
|
物质 项目 |
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4
(催化剂) 100℃-125℃ |
PdCl2-CuCl2 (催化剂) 100℃-125℃ |
|
平衡转化率 |
乙炔转化率 90% |
乙烯转化率 80% |
|
反应速率 |
较 慢 |
较 快 |
|
原料来源生产工艺 |
CaCO3
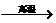 CaO CaO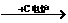 CaC2 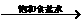 C2H2 C2H2 |
石油裂解气 |
(1) 实验室用乙醇氧化制乙醛的化学方程式:_______________________ ;
(2) 乙醛与新制Cu(OH)2 反应的化学方程式:_____________________________ 。
(3) 某裂解气中各成分的体积分数分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯(C4H6)10%、氢气35 % ,将其通入溴水充分反应,干燥后剩余气体的平均相对分子质量为:____________(精确到0.01)。
(4)现代工业中,乙烯氧化法有取代乙炔水化法的趋势。通过表中信息,请说出其中的三个原因:__________________ 、____________________、 。
23.(10分)在足量的稀氯化亚铁溶液中加入1-2滴液溴,振荡后溶液变为黄色。
(1) 甲同学认为是Br2溶于水变成黄色溶液 ; 乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断 (填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
|
选用试剂 |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)①若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或“不可行”):
________ ,理由: _____________________________ ;
②向稀溴化亚铁溶液中通入过量氯气的离子反应方程式: ______________ 。
22.(10分) ⑴ 以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表 (g/100g水)
|
温度 溶解度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
- |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①.反应控制在30-35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为_________________ ;
②.加料完毕,保温30分钟,目的_____________________________ ;
③.静置后只析出NaHCO3晶体的原因_______________________________ ;
④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
⑵我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:

⑤ 沉淀池中反应的化学方程式: _______-_______ __ ;
⑥ 检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
⑦循环(I)中应该加入或通入物质的化学式为 。
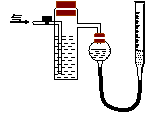 方案(二):右图中反应管内装有碘的淀粉溶液,意图为将空气(内含N2、O2、CO2、SO2等)通过此装置,其中的SO2被吸收(反应为:SO2+2H2O+I2=H2SO4+2HI
),量气管内增加的体积为其余气体的体积。
方案(二):右图中反应管内装有碘的淀粉溶液,意图为将空气(内含N2、O2、CO2、SO2等)通过此装置,其中的SO2被吸收(反应为:SO2+2H2O+I2=H2SO4+2HI
),量气管内增加的体积为其余气体的体积。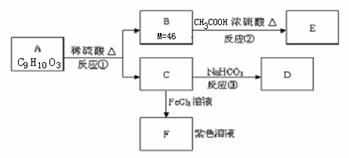
 (1)铜与浓硝酸反应的化学方程式:_______________________;
(1)铜与浓硝酸反应的化学方程式:_______________________;
 属于醇类
属于醇类