摘要:钠的化合物 例题2-2-1 将70 g过氧化钠和氧化钠的混合物跟98 g水充分反应.所得氢氧化钠溶液的溶质质量分数为 50%.试写出过氧化钠跟水反应的化学方程式.并计算原混合物中过氧化钠和氧化钠的质量各为多少? 解析与答案 本题解题关键是对所得NaOH溶液的溶质质量分数50%的分析.可以有两种理解: (1) 根据溶质质量分数的概念进行计算: w=×100% (2) 根据所生成溶液中溶质和溶剂的质量相等进行计算. 解:发生的反应为: Na2O+H2O=2NaOH,2Na2O2+2H2O=4NaOH+O2↑ 设混合物中含Na2O2和Na2O质量分别为x.y. 2Na2O2+2H2O=4NaOH+O2↑, 2×78 2×18 4×40 32 x x x x Na2O+H2O=2NaOH 62 18 2×40 y y y [解法一] [解法二] 解得:x=39g, y=31g. 答案: ①2Na2O2+2H2O=4NaOH+O2↑, ②原混合物中含Na2O2 39 g.Na2O 31g. 例题2-2-2 今有Na2CO3.NaHCO3和NaCl的混合物100g.加热到质量不再减少为止.剩余残渣为84.5g.将残渣溶于水.滴入足量AgNO3溶液得到白色沉淀.加足量稀HNO3后大部分沉淀消失.剩余沉淀为12.26g.试计算混合物中Na2CO3.NaHCO3和NaCl的质量分数各是多少? 解析与答案 要计算Na2CO3.NaHCO3和NaCl的质量分数.必须求出它们在100 g混合物中各自的质量.从条件分析.这三种物质加热.只有NaHCO3受热分解.而Na2CO3.NaCl不分解.加热后剩余残渣为84.5g.减少的质量是NaHCO3加热分解跑走的CO2和H2O的质量.以此为突破口求出NaHCO3的质量,然后滴加AgNO3溶液.再加足量稀HNO3.剩余沉淀为12.26g是AgCl的质量.根据方程式再求出NaCl的质量.最后求出Na2CO3的质量. △ 解:设混合物中含NaHCO3的质量为x.NaCl的质量为y. 2NaHCO3=Na2CO3+H2O↑+CO2↑ 2×84 18 44 62 x 100 g-84.5 g=15.5 g 求得:x=42g. NaCl + AgNO3=NaNO3 + AgCl↓
网址:http://m.1010jiajiao.com/timu3_id_393625[举报]
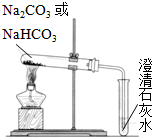 碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.
碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱.(1)用如图装置分别加热上述两种固体,当观察到澄清石灰水变浑浊时,则试管中加热的固体是
(2)若分别向碳酸钠溶液和碳酸氢钠溶液中滴加足量稀盐酸,都能观察到的现象是
(3)钠的化合物中,除了碳酸钠和碳酸氢钠外,还有
Ⅰ.下列实验操作或对实验事实的描述不正确的是
①配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末
④用瓷坩埚熔化各种钠的化合物
⑤实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
⑥测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多.
Ⅱ.在 K2Cr2O7+HCl--KCl+CrCl3+Cl2↑+H2O反应中.
(1)氧化剂是
(2)在参加反应的盐酸中,被氧化的HCl与未被氧化的HCl的质量比为
(3)如果反应生成0.1molCl2,则转移电子的数目为
查看习题详情和答案>>
②④⑥
②④⑥
(填序号)①配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
③仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末
④用瓷坩埚熔化各种钠的化合物
⑤实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
⑥测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多.
Ⅱ.在 K2Cr2O7+HCl--KCl+CrCl3+Cl2↑+H2O反应中.
(1)氧化剂是
K2Cr2O7
K2Cr2O7
,盐酸中-1价的氯元素
盐酸中-1价的氯元素
元素被氧化,氧化产物是Cl2
Cl2
.(2)在参加反应的盐酸中,被氧化的HCl与未被氧化的HCl的质量比为
3:4
3:4
.(3)如果反应生成0.1molCl2,则转移电子的数目为
1.204×1023
1.204×1023
.
如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题: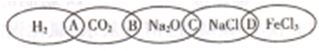
(1)请将分类依据代号填人相应的括号内:
两种物质都不是电解质
两种物质都是钠的化合物
两种物质都是氧化物
两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol?L-的上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体.
①物质M的化学式为 .
②证明有红褐色胶体生成的实验操作是 .
查看习题详情和答案>>

(1)请将分类依据代号填人相应的括号内:
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol?L-的上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体.
①物质M的化学式为
②证明有红褐色胶体生成的实验操作是
(1)阅读下面科普信息,回答问题:
一个正常的成年健康人体内含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在.亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收.
问题:
这则科普信息介绍了人体内中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径.
①能在人体进行Fe2+和Fe3+的转化,这说明亚铁离子具有
②服用维生素C,可以使食物中的Fe3+还原成Fe2+,这句话指出维生素C具有
③市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的离子方程式为:
(2)6月30日,我国的蛟龙号潜水艇成功的潜入水下七千米,在此潜艇中使用一种钠的化合物做供氧剂.请写出此供氧剂与二氧化碳反应的化学方程式为:
查看习题详情和答案>>
一个正常的成年健康人体内含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在.亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收.
问题:
这则科普信息介绍了人体内中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径.
①能在人体进行Fe2+和Fe3+的转化,这说明亚铁离子具有
还原
还原
性,铁离子具有氧化性
氧化性
性;②服用维生素C,可以使食物中的Fe3+还原成Fe2+,这句话指出维生素C具有
还原
还原
性,在此转化中过程做还原
还原
剂;③市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐.此反应的离子方程式为:
Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)6月30日,我国的蛟龙号潜水艇成功的潜入水下七千米,在此潜艇中使用一种钠的化合物做供氧剂.请写出此供氧剂与二氧化碳反应的化学方程式为:
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
.