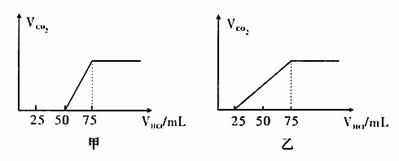
5.下列有关叙述正确的是( )
 A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
A. “神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐” “含氟牙膏”“富硒营养品” “高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C. 右图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:
2 A(g)+ B(g) = 2 C(g);△H=Q kJ·mol-1(Q<0 )
D.电解水制取氢气和氧气时,通常加入硫酸钠等强电解质,这说明强电解质的导电性比弱电解质的导电性强
|
 H2O+NH2Cl,下列有关氯胺的说法不正确的是
H2O+NH2Cl,下列有关氯胺的说法不正确的是
A.氯胺的消毒原理与漂白粉相似 B. 氯胺的电子式为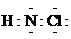
C.氯胺与浓盐酸混合可产生氯气 D. 氯胺在水中水解最初产物为NH2OH和HCl