网址:http://m.1010jiajiao.com/timu3_id_392782[举报]
(1)淡黄色粉末的名称_________________;
(2)溶液中肯定有_________离子,肯定没有_________离子;
(3)溶液中含有上述离子的物质的量之比为________________;
(4)上述过程中涉及的有关反应的离子方程式为:_______________、______________、______________、_________________、_________________。
查看习题详情和答案>>(1)淡黄色粉末名称是________。
(2)溶液中肯定有________离子;肯定没有________离子。
(3)溶液中离子的物质的量之比是________。
查看习题详情和答案>>
有一透明溶液,已知其中可能含有Fe2+,![]() ,Al3+,Cu2+,Mg2+。当加入一种淡黄色粉末状固体物质并微热时,产生有刺激性气味的混合物,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀量最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,当加入0.45mol粉末时,沉淀由0.3mol减少到0.2mol。再加粉末时,沉淀就不再减少。由实验现象及数据判断:
,Al3+,Cu2+,Mg2+。当加入一种淡黄色粉末状固体物质并微热时,产生有刺激性气味的混合物,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀量最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,当加入0.45mol粉末时,沉淀由0.3mol减少到0.2mol。再加粉末时,沉淀就不再减少。由实验现象及数据判断:
(1)淡黄色粉末名称是________。
(2)溶液中肯定有________离子;肯定没有________离子。
(3)溶液中离子的物质的量之比是________。
查看习题详情和答案>>
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、![]() ,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示:根据题意同答下列问题:
,加入一种淡黄色粉末状固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀.当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示:根据题意同答下列问题:
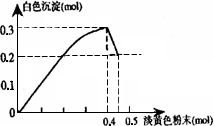
(1)淡黄色粉末为________(填名称)
(2)溶液中肯定有________离子,肯定没有________.
(3)溶液中离子的物质的量之比为________
(4)写出下列方程式:
①淡黄色粉末与水反应的化学方程式:________________________
②产生刺激性气味气体的离子方程式:________________________
③沉淀部分减少时的离子方程式:____________________________
(14分)有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中各离子的物质的量之比为
________________________________________________________________________。
(4)写出下列反应方程式:
①淡黄色粉末与水反应的化学方程式:____________________________________。
②刺激性气味的气体产生的离子方程式:______________________________________。
③沉淀部分减少时的离子方程式:_______________________________________。
查看习题详情和答案>>