1.离子反应,此类试题考查的主要内容有:
(1)理解离子反应的概念,
(2)掌握离子反应发生的条件,
(3)会判断离子在溶液中能否大量共存。
命题主要以选择题的形式出现,是高考中常见题型和必考知识点。
32.抗击“非典”期间,过氧乙酸CH3C-O-OH是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:





 ① MnO4-+ H2O2+ H+= Mn2++ O2+ H2O
① MnO4-+ H2O2+ H+= Mn2++ O2+ H2O
|
③CH3C-O-OH+2I-+2H+=CH3COOH+I2+H2O
④2Na2S2O3+I2=2NaI+Na2S4O6





 (1)① Mn4-+ H2O2+ H+= Mn2++ O2+ H2O
(1)① Mn4-+ H2O2+ H+= Mn2++ O2+ H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是 。
(3)取b0mL待测液,用硫酸使溶液酸化,再用浓度为a1mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(反应②和③)。再用浓度为a2mol·L-1的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)
c0= 。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 (填是或否)
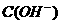 =1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( ) 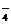 等有颜色离子。
等有颜色离子。 。
。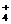 NO
NO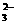 Na+ B.
Na+ Ba2+ Mg2+ HCO
Na+ B.
Na+ Ba2+ Mg2+ HCO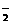 OH- D.
NO
OH- D.
NO H2S+2OH-
H2S+2OH-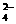 、CO
、CO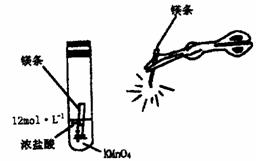 29.高锰酸钾可将浓盐酸氧化成氯气。现将0.05g高锰酸钾和一段镁条放入同一试管中,加入1.5mL浓盐酸后立即塞上软木塞,并用一根燃着的镁条在试管附近进行强光照射,如下图所示。请回答下列问题:
29.高锰酸钾可将浓盐酸氧化成氯气。现将0.05g高锰酸钾和一段镁条放入同一试管中,加入1.5mL浓盐酸后立即塞上软木塞,并用一根燃着的镁条在试管附近进行强光照射,如下图所示。请回答下列问题: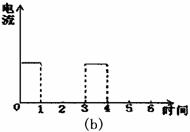
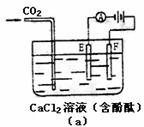 30.如下图(a)为持续电解饱和CaCl2水溶液的装置(以铂为电极,A为电流表),电解一段时间后,从图(b)1小时起将CO2连续通入电解液中,请在图(b)中完成实验(a)中电流对时间的变化关系图,并回答有关问题。
30.如下图(a)为持续电解饱和CaCl2水溶液的装置(以铂为电极,A为电流表),电解一段时间后,从图(b)1小时起将CO2连续通入电解液中,请在图(b)中完成实验(a)中电流对时间的变化关系图,并回答有关问题。