网址:http://m.1010jiajiao.com/timu3_id_375176[举报]
(15分)A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)

(1)写出下列物质的化学式B______, F_______,H______。A和G的最简单气态氢化物中,较稳定的物质是 (填化学式),写出反应①的化学方程式 。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G=1:1 B.反应②:A:D=1:1
C.反应③:A:J=2:1 D.反应④:E:B =1:1
查看习题详情和答案>>
(15分)A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中 得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
(1)写出下列物质的化学式B______, F_______, H______。A和G的最简单气态氢化物中,较稳定的物质是 (填化学式),写出反应①的化学方程式 。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)
(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G="1:1 " B.反应②:A:D=1:1
C.反应③:A:J="2:1 " D.反应④:E:B =1:1
(15分)A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
(1)写出下列物质的化学式B______, F_______, H______。A和G的最简单气态氢化物中,较稳定的物质是 (填化学式),写出反应①的化学方程式 。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G=1:1 B.反应②:A:D=1:1
C.反应③:A:J=2:1 D.反应④:E:B =1:1
查看习题详情和答案>>
 得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)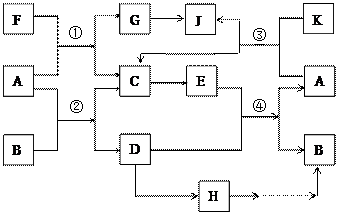
(1)写出下列物质的化学式B______, F_______, H______。A和G的最简单气态氢化物中,较稳定的物质是 (填化学式),写出反应①的化学方程式 。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)

(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为 。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G="1:1 " B.反应②:A:D=1:1
C.反应③:A:J="2:1 " D.反应④:E:B =1:1
