0 37416 37424 37430 37434 37440 37442 37446 37452 37454 37460 37466 37470 37472 37476 37482 37484 37490 37494 37496 37500 37502 37506 37508 37510 37511 37512 37514 37515 37516 37518 37520 37524 37526 37530 37532 37536 37542 37544 37550 37554 37556 37560 37566 37572 37574 37580 37584 37586 37592 37596 37602 37610 447348
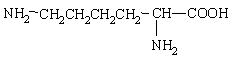 (4分)某种豆类作物中所含的天然蛋白质在酶的作用下发生水解,可得到甲、乙2种氨基酸。已知甲的结构简式为
,乙的分子式为C4H7O4N.
(4分)某种豆类作物中所含的天然蛋白质在酶的作用下发生水解,可得到甲、乙2种氨基酸。已知甲的结构简式为
,乙的分子式为C4H7O4N.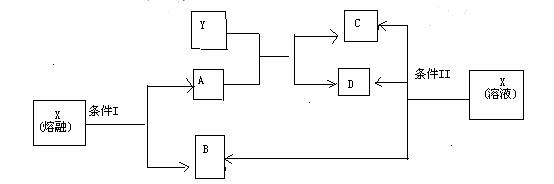
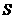 、
、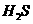 、
、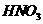 、
、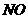 、
、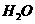 。该反应中还原剂是______;该反应中还原产物是______;若反应过程中转移了0.3
。该反应中还原剂是______;该反应中还原产物是______;若反应过程中转移了0.3 电子,则氧化产物的质量是______
电子,则氧化产物的质量是______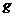 。
。 a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te
a.碲(Te)为固体,H2Te为气体,Te和H2不能直接化合生成H2Te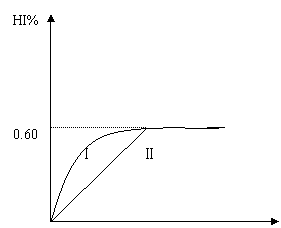 第二个离子反应的离子方程式是
第二个离子反应的离子方程式是
 最后一个离子反应的离子方程式是
最后一个离子反应的离子方程式是
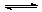 2HI(g);
2HI(g);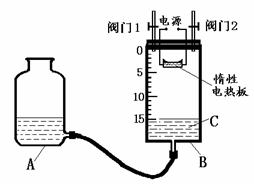 (7分) 某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100
cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其它夹持装置已略去。操作步骤:
(7分) 某同学设计了如图所示测定红磷在氯气中燃烧产物的分子式的装置,该装置中B是底面积为100
cm2的圆筒状玻璃容器(密封盖上装有阀门),上面标有厘米单位的刻度,其它夹持装置已略去。操作步骤:


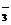 离子是否存在
离子是否存在