25.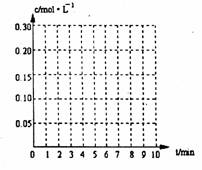 (8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=amol/L。
(8分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=amol/L。
(1)0min-4min内生成O2平均速率v(O2)= mol/L·min
(2)达到平衡时c(O2)=c(SO2),则a= mol/L,在下列
坐标系中作出0min-8min及之后SO2、O2、SO3浓度
随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol/L的是
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
24.(8分)2005年诺贝尔化学奖由法国科学家YvesChauvin、美国科学家RobertH.Orubbs、 RichardR.Schrock共同获得。以表彰他们在烯烃复分解反应方面研究与应用所作出的贡献。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。可表示为:
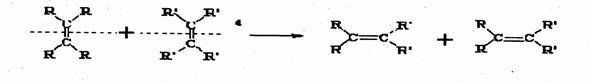
|
 又已知:R-CH2-CH=CH2+Cl2
R-CH Cl –CH=CH2+HCl
又已知:R-CH2-CH=CH2+Cl2
R-CH Cl –CH=CH2+HCl
有机物R是烃的含氧衍生物(分子式为:C9H14O6),常用作纤维的增塑剂以及化妆晶等,F也可由油脂水解得到,有机物R的合成路线如下:
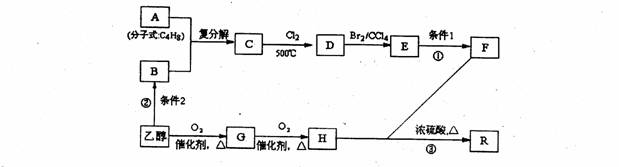 试回答下列问题
试回答下列问题
(1)写出反应①、②的反应条件:条件1 ;条件2 。
(2)写出结构简式,A: ;E: 。
(3)写出反应③的化学方程式: 。
20.(12分)亚硝酰氯(C1NO)是有机合成中的重要试剂,可由NO与C12在通常条件下反应得到, 另外硝酰氯可由二氧化氮与氯气作用得到。某研究性学习小组拟在通风橱中制取亚硝酰氯,先查得其如下资料:
|
英文名称 |
nitrosylchloride nitrogenoxychloride |
别名 |
氯化亚硝酰;氧氯化氮 |
|||
|
分子式 |
C1NO |
外观与性状 |
红褐色液体或黄色气体,具有刺鼻恶臭味,遇水和潮气分解成氮的氧化物和氯化氢。 |
|||
|
熔点 |
-64.5℃沸点:-5.5℃ |
溶解性 |
溶于浓硫酸 |
|||
|
危险标记 |
有毒气体,有机剧毒品 |
主要用途 |
用于合成清洁剂、触媒及中间体 |
|||
后他们拟定了如下合成装置示意图:
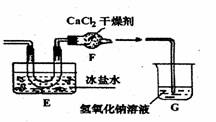
|
|
|
|


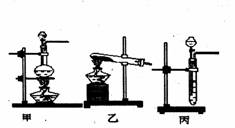
试回答下列问题:
(1)制备NO最好选用的装置是 (选填:甲、乙、丙,下同),制备C12应选用
的装置是 。
(2)实验室制取氯气的化学方程式为 。
(3)无水氯化钙的作用是: 。
(4)写出亚硝酰氯水解的化学方程式: 。
(5)指导老师认为装置G不能有效除去有毒气体,写出你的见解和改进措施。
。

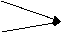
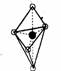 (5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,
(5)已知B的结构为三角双锥(如右图示),图中○代表F分子,●代表E原子,