28.(5分)已知高温下能发生如下反应:SiO2+2C Si+2CO,Si+C
Si+2CO,Si+C SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表中:
SiC。现有石英砂和碳粉的混合物a mol,在高温电炉中隔绝空气充分反应,反应完全后,冷却得到残留固体。若石英砂与混合物的物质的量之比为x(0<x<1),试讨论x的取值范围,残留固体的成分和物质的量,并将结果填入下表中:
说明:①残留固体物质的量用a,x等表示,不必列出具体的计算式。
②每组空格填一种情况,有几种填几种,不必填满。
|
x值 |
残留固体 |
|
|
分子式(或化学式) |
物质的量/mol |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
高三化学全国统一标准测试(二)答案
26.(9分)SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下实验装置:
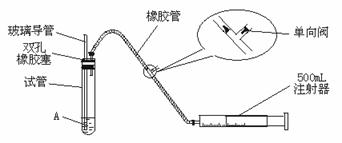
(1)检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后 (填写操作方法)时,将会看到 (填写实验现象),则证明该装置的气密性良好。
(2)向试管中加入0.0005 mol·L-1的碘水1.0 mL,用适量的蒸馏水稀释后再加入2-3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由 色变为 色时反应恰好完全进行,此时停止抽气,该反应的化学方程式为 。
(3)我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
|
浓度限值/mg·m-3 |
||
|
一级标准 |
二级标准 |
三级标准 |
|
0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A,在同一地点、同时测量空气中SO2的含量。当反应恰好完全进行,记录抽气次数如下(假设每次抽气500 mL)。请将下表填写完整(计算时保留2位有效数字):
|
分组 |
第一小组 |
第二小组 |
|
抽气次数 |
120 |
140 |
|
SO2含量/mg·m-3 |
|
|
判断该地点的空气中SO2的含量属于 (填数字)级标准, (“第一”或“第二”)小组的测定结果正确,另一小组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题) 。
6.向氯化铝溶液中滴加NaOH溶液
Ⅱ.实验现象
A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变红色
B.产生大量气体,可在空气中燃烧,溶液变成浅红色
C.反应剧烈,产生气体可燃烧
D.剧烈反应,产生气体能在空气中燃烧
E.生成白色沉淀,继而沉淀消失
F.生成淡黄色沉淀
现在请你帮助该学生整理并完成实验报告。
(1)实验目的:验证同周期元素性质的递变规律
(2)实验用品:仪器:试管、砂纸、镊子、滤纸、小刀、 、 药品:(略)
(3)实验内容(在下列空格内填写相关内容)
|
实验方案顺序 |
实验现象 |
有关反应的化学方程式 |
|
3 |
A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
2 |
|
|
(4)实验结论: 。
(5)问题和讨论:
①请用结构理论简单说明得出上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另外两种元素性质的递变规律。