(一)卤素的原子结构和单质的物理性质
随卤素核电荷数增加,电子层数依次递增,原子半径渐增大,其原子结构的递变而使卤素单质的物理性质呈规律性变化.
 从F2 I2
从F2 I2
1、
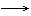
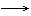 颜色渐加深,状态从气 液 固,密度从小 大,熔沸点由低 高(分子晶体)
颜色渐加深,状态从气 液 固,密度从小 大,熔沸点由低 高(分子晶体)
2、单质的溶解性--除氟外(与水剧烈反应)在水中溶解度都较小,且由大 小,都易溶于有机溶剂,下表列出Cl2、Br2、I2在不同溶剂中的颜色.
|
|
水 |
CCl4 |
汽油(苯) |
|
Cl2 |
黄绿色 |
黄绿色 |
黄绿色 |
|
Br2 |
橙色 |
橙红色 |
橙红色 |
|
I2 |
棕黄色 |
紫色 |
紫红色 |
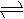 氯水不稳定,因为氯水中存在如下平衡:Cl2+H2O HCl+HClO,为了提高氯水的
氯水不稳定,因为氯水中存在如下平衡:Cl2+H2O HCl+HClO,为了提高氯水的 易升华
易升华 ④卤化氢--均易溶于水,在空气中形成白雾,其中只有HF剧毒,但HX都是大气污染物,水溶液均呈酸性,只有氢氟酸是弱酸,从HF HI,酸性逐渐增强.
④卤化氢--均易溶于水,在空气中形成白雾,其中只有HF剧毒,但HX都是大气污染物,水溶液均呈酸性,只有氢氟酸是弱酸,从HF HI,酸性逐渐增强. ⑧
⑧ 2NaCl+H2SO4(浓) △ Na2SO4+2HCl↑(加强热)
2NaCl+H2SO4(浓) △ Na2SO4+2HCl↑(加强热) (3)HBr--浓H3PO4和NaBr反应 NaBr+H3PO4(浓) △ NaH2PO4+HBr↑
(3)HBr--浓H3PO4和NaBr反应 NaBr+H3PO4(浓) △ NaH2PO4+HBr↑ 向上排空气法
向上排空气法 Cl2、H2S、SO2、NO2等一般用NaOH才能完全吸收(H2S还可用CuSO4
Cl2、H2S、SO2、NO2等一般用NaOH才能完全吸收(H2S还可用CuSO4 MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2O--实验室通常用该法制Cl2
MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2O--实验室通常用该法制Cl2 KMnO4+HCl(浓)--
KClO3+HCl(浓) △
KMnO4+HCl(浓)--
KClO3+HCl(浓) △  Ca(ClO)2+HCl(浓)-- NaCl+H2O
电解 (工业制 Cl2)
Ca(ClO)2+HCl(浓)-- NaCl+H2O
电解 (工业制 Cl2) ⑥历史上曾用地康法制Cl2 HCl(气)+O2
⑥历史上曾用地康法制Cl2 HCl(气)+O2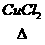 Cl2+H2O试根据以上反应比较KMnO4、MnO2、O2三种物质的氧化性强弱(氧化性KMnO4>MnO2>O2)
Cl2+H2O试根据以上反应比较KMnO4、MnO2、O2三种物质的氧化性强弱(氧化性KMnO4>MnO2>O2) 用向上排空气法
用向上排空气法