0 35200 35208 35214 35218 35224 35226 35230 35236 35238 35244 35250 35254 35256 35260 35266 35268 35274 35278 35280 35284 35286 35290 35292 35294 35295 35296 35298 35299 35300 35302 35304 35308 35310 35314 35316 35320 35326 35328 35334 35338 35340 35344 35350 35356 35358 35364 35368 35370 35376 35380 35386 35394 447348
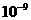 m)的超细粉末粒子,
m)的超细粉末粒子, 3C(g);已知加入1 mol A和3 mol B且达到平衡时生成a mol C。
3C(g);已知加入1 mol A和3 mol B且达到平衡时生成a mol C。
