3、乙烯制法
|
 CH3CH2OH 浓H2SO4 CH2=CH2↑+H2O
CH3CH2OH 浓H2SO4 CH2=CH2↑+H2O
 思考:实验室制乙烯实验中,浓H2SO4作用?乙醇与浓H2SO4混合液为何发黑?从实验装置中排出乙烯直接通入溴水与用排水法收集的乙烯通入溴水哪个褪色速率快?为什么?(浓H2SO4是催化剂,脱水剂。浓硫酸的副作用:强氧化性 CH3CH2OH+
H2SO4(浓) △ C+SO2+H2O。直接通入溴水速率快,因为乙烯中含有SO2气体,迅速与溴水反应)
思考:实验室制乙烯实验中,浓H2SO4作用?乙醇与浓H2SO4混合液为何发黑?从实验装置中排出乙烯直接通入溴水与用排水法收集的乙烯通入溴水哪个褪色速率快?为什么?(浓H2SO4是催化剂,脱水剂。浓硫酸的副作用:强氧化性 CH3CH2OH+
H2SO4(浓) △ C+SO2+H2O。直接通入溴水速率快,因为乙烯中含有SO2气体,迅速与溴水反应)
3、
 CH4制取:CH3-C-ONa+NaOH CaO CH4↑+Na2CO3
CH4制取:CH3-C-ONa+NaOH CaO CH4↑+Na2CO3
该反应的基本类型为取代反应(脱羧),在运用中有以下几例:
(1) 1mol CH3COOH与含2mol NaOH溶液反应后,蒸干灼烧,所得固体物质是什
么?
(2)有机物A只含C、H、O三种元素,并含有苯环,苯环上的一取代物只有二种。
|

 A(C7H6O3) 碱石灰 B
A(C7H6O3) 碱石灰 B  C6H6O(遇浓溴水有白色沉淀),推测A的结构。并写出有关化学方程式。
C6H6O(遇浓溴水有白色沉淀),推测A的结构。并写出有关化学方程式。
解析:(1)CH3COOH与NaOH中和后得到等物质的量的CH3COONa和NaOH,蒸干灼烧后理论上应生成CH4和Na2CO3固体。
(2)A化学式为C7H6O3通过碱石灰反应后,生成C6H6O(显然为苯酚),少了一个碳原子,证明发生了脱羧反应,同时说明A中应有一个-COOH和一个酚羟基,由于一取代物只有二种同分异构体,则其结

 COOH
COOH
 构应为 。有关反应方程式为:
构应为 。有关反应方程式为:
 OH
OH



 COOH
ONa
COOH
ONa


 +3NaOH △ +Na2CO3+H2O
+3NaOH △ +Na2CO3+H2O
 OH
OH



 ONa
OH
ONa
OH

 +HCl→ +NaCl
+HCl→ +NaCl



 OH
OH
OH
OH
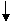

 +3Br2→Br- -Br +3HBr
+3Br2→Br- -Br +3HBr
 Br
Br

 1、分子结构H-C=C-H直线型,判断分子中原子是否共线,一般含-C=C-
1、分子结构H-C=C-H直线型,判断分子中原子是否共线,一般含-C=C- 2、化学性质
2、化学性质


 加成反应,特点:逐步加成,由于-C=C-键能比C=C 键能大,因此使溴水褪
加成反应,特点:逐步加成,由于-C=C-键能比C=C 键能大,因此使溴水褪 色的速率CH=CH比
色的速率CH=CH比
 思考:如何制取CH2―CHCl?
思考:如何制取CH2―CHCl? (先将CH=CH与HCl加成,注意条件,再将加成产物与Br2加成)
(先将CH=CH与HCl加成,注意条件,再将加成产物与Br2加成)
 注意:CH=CH+H2O
催化剂 CH2=CH(不稳定)→CH3CHO
注意:CH=CH+H2O
催化剂 CH2=CH(不稳定)→CH3CHO (2)氧化反应 燃烧--现象?有何应用?(签别乙烯、乙炔)及氧炔焰。
(2)氧化反应 燃烧--现象?有何应用?(签别乙烯、乙炔)及氧炔焰。



 (3)聚合反应 3CH=CH 催化剂 。
(3)聚合反应 3CH=CH 催化剂 。





 1、(1)CH3-CH2-CH2-CH3和CH3-CH-CH3 、
1、(1)CH3-CH2-CH2-CH3和CH3-CH-CH3 、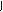
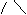 O
O
O
O


 O O
O O 1.2-加成(非极性溶剂中)
1.2-加成(非极性溶剂中)
 CH3
CH3 ―CH2―C―CH―CH2―
―CH2―C―CH―CH2― S
S


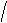 SO3H
SO3H
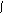
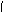 其单体为: CH2=CH2、CH2=CH-CH=CH2。
其单体为: CH2=CH2、CH2=CH-CH=CH2。 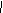
 CH=CH2
CH=CH2  答:(1)C: –CH=CH2 D: (2)-SO3H,酸性
答:(1)C: –CH=CH2 D: (2)-SO3H,酸性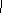



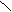
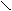

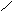







 [ CH2―CH2 ]n 催化剂 CH2=CH2 HX CH3―CH2
[ CH2―CH2 ]n 催化剂 CH2=CH2 HX CH3―CH2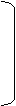 CaC2 H2O CH=CH NaOH/醇 CH2―CH2 [O] CH3―CH2OH
CaC2 H2O CH=CH NaOH/醇 CH2―CH2 [O] CH3―CH2OH

 O O 分子间脱水 CH2―CH2
→酯
O O 分子间脱水 CH2―CH2
→酯
 (取代) OH OH
(取代) OH OH
 ↓[O]
链状酯HOOC―COOCH2―CH2―OH
↓[O]
链状酯HOOC―COOCH2―CH2―OH
 烯烃与环烷烃
烯烃与环烷烃
 CH3
CH3
 以及 CH2=C-CH2-CH3共四种。
以及 CH2=C-CH2-CH3共四种。 CH2
CH2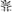 解析:据题意,A可能为烃或烃的含氧衍生物,若为烃,
解析:据题意,A可能为烃或烃的含氧衍生物,若为烃, 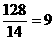 ……余2则为C9H20,若再多一个C原子则为C10H8( )。若含氧,则每增加一个氧原子,C9H2O中少一个C原子和4个H原子。(式量必须为12),可能的分子式为C9H20、C10H8、C8H16O、C7H12O2、C6H8O3。
……余2则为C9H20,若再多一个C原子则为C10H8( )。若含氧,则每增加一个氧原子,C9H2O中少一个C原子和4个H原子。(式量必须为12),可能的分子式为C9H20、C10H8、C8H16O、C7H12O2、C6H8O3。 原子,应为C7H12O2,其结构简式是 -COOH,环上有一个H原子被-NH2取代后的物质为氨基酸,氨基酸与
原子,应为C7H12O2,其结构简式是 -COOH,环上有一个H原子被-NH2取代后的物质为氨基酸,氨基酸与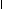


 CH3
CH3 CH3 CH3
CH3
CH3 CH3 CH3
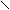

 硝基化合物互为同分异构体,其结构简式 -NO2、 、 、 NO2 。
硝基化合物互为同分异构体,其结构简式 -NO2、 、 、 NO2 。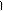 - NO2
- NO2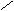
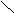 四、乙烯 H H
NO2
四、乙烯 H H
NO2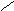
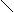 1、分子结构 C=C 。 同学们一定要掌握以下几点:
1、分子结构 C=C 。 同学们一定要掌握以下几点: 键角1200,分子中所有原子在同一平面,除了C=C 共面外,还有苯环结构,在判断原子共面上经常用到。
键角1200,分子中所有原子在同一平面,除了C=C 共面外,还有苯环结构,在判断原子共面上经常用到。 C=C 键能不等于两个单键键能之和,比二倍略小,说明双键中有一个键易断裂。
C=C 键能不等于两个单键键能之和,比二倍略小,说明双键中有一个键易断裂。


 CH3
CH3
CH3
CH3
CH3
CH3 CH3-C-C-CH3)
CH3-C-C-CH3) (3)分解反应:CH4 高温 C+2H2
(3)分解反应:CH4 高温 C+2H2