网址:http://m.1010jiajiao.com/timu3_id_353259[举报]
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
① 基态Fe3+的M层电子排布式为 。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)

(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是 _。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

① 图中d单质的晶体堆积方式类型是 。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。
查看习题详情和答案>>
① 基态Fe3+的M层电子排布式为 。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)
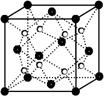
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是 _。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

① 图中d单质的晶体堆积方式类型是 。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。