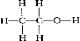
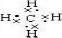摘要:甲烷化学性质 这也是烷烃共同具有的一个性质.有关该反应应注意: ① 纯卤素②光照条件③逐步取代④1mol卤素只取代1molH原子. 思考:①1mol烃A与2mol HCl恰好加成.生成化合物B. 1mol B完全取代需4molCl2.则烃A属于什么烃? ② 1molCH4完全以代需几molCl2?在所得产物中:物质的量最大的是 ? 含H量最小的是 ?产物为非极性分子的是 ? ③ 在烃的衍生物中,常温下为气态的有 ? ④ 烷烃中C原子数在10以内的一卤代物只有一种的烷烃有 种? (① A+2HCl-B.B需4mol Cl2完全取代.说明B分子中含4mol H原子.A中则含2mol H原子.因此为CH=CH O CH3 ②4molCl2.HCl.CCl4.CCl4.③CH3Cl.H-C-H.④CH4.C2H6.CH3-C-CH3. CH3 CH3 CH3 CH3-C-C-CH3) CH3 CH3 (2)氧化反应--仅指在空气或氧气中燃烧 (3)分解反应:CH4 高温 C+2H2 O
网址:http://m.1010jiajiao.com/timu3_id_353251[举报]
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为 ;
(2)H2O分子中氧原子采取的是 杂化.写出与H2O分子互为等电子体的微粒 .(写一个即可)
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是 .
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
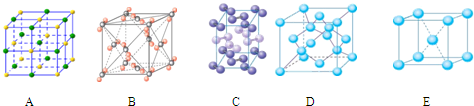
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是 (请用相应的编号填写)
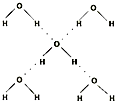
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式: .
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
① ;② .
查看习题详情和答案>>
(1)水分子中氧原子在基态时核外电子排布式为
(2)H2O分子中氧原子采取的是
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是


(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 | 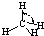 |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 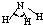 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 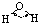 |
104.5° | 水 | 0.0 | 100.0 |
氟、氯、溴、碘4种元素同属于元素周期表中ⅧA族.
(1)氯可广泛存在于无机物和有机物中.二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是 .氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 (填“极性”或“非极性”)分子.
(2)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电.在冰晶石(Na3AlF6)晶体中存在 (填序号).
a.离子键 b.极性键
c.配位键 d.范德华力
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为 .已知其中一种化合物的化学式为KCuCl3,另一种化合物的化学式为 .

(4)氢氟酸是弱酸的原因是 .
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质相似的化合物,称为拟卤素.一个氰分子中含有 个π键.
查看习题详情和答案>>
(1)氯可广泛存在于无机物和有机物中.二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是
(2)冰晶石(Na3AlF6)主要用作电解Al2O3生产铝的助熔剂,其晶体不导电,但熔融时能导电.在冰晶石(Na3AlF6)晶体中存在
a.离子键 b.极性键
c.配位键 d.范德华力
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为

(4)氢氟酸是弱酸的原因是
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质相似的化合物,称为拟卤素.一个氰分子中含有
下面是某同学通过一年的化学学习,对所学化学知识进行归纳的情况.
(1)对环境污染及治理方法连线正确的是
A.减缓“温室效应”--使用新型能源
B.防止水的污染--提倡使用无磷洗衣粉
C.控制酸雨--煤经过脱硫处理后再燃烧
(2)下列化学处理措施与解释不吻合的是
A.木材着火用水泼灭--降低可燃物的着火点
B.焊接金属时常用氮气作保护气--氮气的化学性质不活泼
C.刚装修好的房间里放活性炭--活性炭有吸附性
(3)对物质的组成或结构关系下列说法不正确的是 ,
A.金刚石和石墨--碳原子排列不同
B.氯原子和氯离子--质子数不同
C.CO和C02-----分子构成不同
(4)对物质的分类正确的是 .
A.甲烷、乙酸、葡萄糖、一氧化碳等属于有机物
B.淀粉、蛋白质、聚乙烯、蔗糖等属于有机高分子
C.食物的成份主要有蛋白质、糖类、油脂、维生素、无机盐和水等六大类,通常称为营养素.
查看习题详情和答案>>
(1)对环境污染及治理方法连线正确的是
A.减缓“温室效应”--使用新型能源
B.防止水的污染--提倡使用无磷洗衣粉
C.控制酸雨--煤经过脱硫处理后再燃烧
(2)下列化学处理措施与解释不吻合的是
A.木材着火用水泼灭--降低可燃物的着火点
B.焊接金属时常用氮气作保护气--氮气的化学性质不活泼
C.刚装修好的房间里放活性炭--活性炭有吸附性
(3)对物质的组成或结构关系下列说法不正确的是
A.金刚石和石墨--碳原子排列不同
B.氯原子和氯离子--质子数不同
C.CO和C02-----分子构成不同
(4)对物质的分类正确的是
A.甲烷、乙酸、葡萄糖、一氧化碳等属于有机物
B.淀粉、蛋白质、聚乙烯、蔗糖等属于有机高分子
C.食物的成份主要有蛋白质、糖类、油脂、维生素、无机盐和水等六大类,通常称为营养素.
氟、氯、溴、碘4种元素同属于周期表中第ⅦA族.
(1)4种元素中电负性最小的基态原子的价电子排布式是 .
(2)氢氟酸是弱酸的原因是 .
(3)氯元素可广泛存在于无机物和有机物中.二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是 ,氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应.CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是 (填“极性”或“非极性”)分子.
(4)冰晶石(Na3AlF6)主要用作电解Al2O33生产铝的助熔剂,其晶体不导电,但熔融时能导电.在冰晶石(Na3AlF6)晶体中存在 (填选项).
A.离子键 B.极性键 C.配位键 D.范德华力
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质很相似的化合物,称为拟卤素.一个氰分子中含有 个π键.
查看习题详情和答案>>
(1)4种元素中电负性最小的基态原子的价电子排布式是
(2)氢氟酸是弱酸的原因是
(3)氯元素可广泛存在于无机物和有机物中.二氯甲烷(CH2Cl2)是甲烷分子中碳原子上连接的两个氢原子被两个氯原子取代形成的一种氯代物,其分子中碳原子轨道的杂化类型是
(4)冰晶石(Na3AlF6)主要用作电解Al2O33生产铝的助熔剂,其晶体不导电,但熔融时能导电.在冰晶石(Na3AlF6)晶体中存在
A.离子键 B.极性键 C.配位键 D.范德华力
(5)氰[(CN)2]是一种分子构型和化学性质与卤素单质很相似的化合物,称为拟卤素.一个氰分子中含有