0 35227 35235 35241 35245 35251 35253 35257 35263 35265 35271 35277 35281 35283 35287 35293 35295 35301 35305 35307 35311 35313 35317 35319 35321 35322 35323 35325 35326 35327 35329 35331 35335 35337 35341 35343 35347 35353 35355 35361 35365 35367 35371 35377 35383 35385 35391 35395 35397 35403 35407 35413 35421 447348
 , 其化学式为CH4,而现在很多涉及有关分子式的计算均由这个经典求法衍变而来,现举二例:
, 其化学式为CH4,而现在很多涉及有关分子式的计算均由这个经典求法衍变而来,现举二例: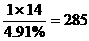 <300,则假设成立, C:
<300,则假设成立, C: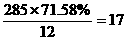 , H:
, H:  , O:
, O: ,C17H19NO3
,C17H19NO3 <158合理.所以B中只含3个氧原子.如何得出A、B的分子式?根A、B均为芳香族化合物且B中有5个不饱和度,B的分子式为CnH2n-8O3,即14n-8+48=138,n=7 A+H2O→C7H6O3+CH3COOH A的分子式C9H8O4(原子守恒法)
<158合理.所以B中只含3个氧原子.如何得出A、B的分子式?根A、B均为芳香族化合物且B中有5个不饱和度,B的分子式为CnH2n-8O3,即14n-8+48=138,n=7 A+H2O→C7H6O3+CH3COOH A的分子式C9H8O4(原子守恒法)



 OH OH OH
OH OH OH
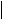 -COOH
-COOH  的。如:NaHCO3与Na2CO3的溶解性与有机酸盐的溶解性一致,即酸式盐溶解度小于正盐。且有机物与无机物可相互转化。如:NH4CNO △ CO(NH2)2
的。如:NaHCO3与Na2CO3的溶解性与有机酸盐的溶解性一致,即酸式盐溶解度小于正盐。且有机物与无机物可相互转化。如:NH4CNO △ CO(NH2)2