22、在碘化钾和硫酸的混合溶液中加过氧化氢水溶液,迅速反应放出大量气体,反应过程可表示如下:
①H2O2 + 2KI
+ H2SO4 == I2 + K2SO4 +
2H2O
②H2O2 + I2 == 2HIO
③H2O2 + 2HIO == I2 + O2↑ + 2H2O
(1)H2O2在反应③中的作用是_____(填标号)。
(A)氧化剂 (B)既是氧化剂又是还原剂
(C)还原剂 (D)既不是氧化剂也不是还原剂
(2)有人认为:上述反应说明了碘单质是过氧化氢分解的催化剂。你认为对吗?_______,其理由是_____________________________________。
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是_____。
23、在某条件下,容器中有如下平衡反应: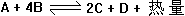 此时,A、B、C的物质的量均为amol,而D的物质的量为dmol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a取值范围应是__________(用a和d的关系式表示)。
(2)如果要使本反应重新建立在平衡中,D物质的量只允许在d到2d之间取值,则应采取的措施是__________________(从下面列出的选项中选择)。
(A)升高反应温度
(B)增大反应容器之压强
(C)增大反应容器容积
(D)降低反应温度
(E)减小反应容器内之压强
(F)减小反应容器容积
24、有两组关于物质熔点的数据
此时,A、B、C的物质的量均为amol,而D的物质的量为dmol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a取值范围应是__________(用a和d的关系式表示)。
(2)如果要使本反应重新建立在平衡中,D物质的量只允许在d到2d之间取值,则应采取的措施是__________________(从下面列出的选项中选择)。
(A)升高反应温度
(B)增大反应容器之压强
(C)增大反应容器容积
(D)降低反应温度
(E)减小反应容器内之压强
(F)减小反应容器容积
24、有两组关于物质熔点的数据
|
|
1组 |
2组 |
||||||
|
物质 |
NaCl |
KCl |
RbCl |
CsCl |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点 |
808℃ |
772℃ |
717℃ |
645℃ |
-70.4℃ |
-49.5℃ |
-36.2℃ |
-15℃ |
分析以上数据,回答: (1)有什么规律可循?__________________。 (2)造成这些规律的主要原因是:______________________。
|
m |
1 |
2 |
3 |
4 |
|
a |
0.25 |
0.45 |
0.56 |
0.62 |
|
x |
16.7% |
21.5% |
19.4% |
16.4% |
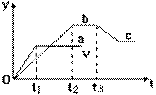 ①所得结论____________________。
②反应物的最佳配比是____________________,其原因是_____________________。
25、已知氯水中有如下平衡,
①所得结论____________________。
②反应物的最佳配比是____________________,其原因是_____________________。
25、已知氯水中有如下平衡, ,常温下,在一容积为
50mL的针铜中吸入40mL氯气后,再吸入10mL水,写出针筒中可能观察到的现象是_____________。若将此针筒长时间放置,又可看到何种变化____________,试用平衡观点加以解释:_____________________________。
26、氯酸与亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如下图所示,又知这个反应速率随着溶液(H+)增大而加快。
,常温下,在一容积为
50mL的针铜中吸入40mL氯气后,再吸入10mL水,写出针筒中可能观察到的现象是_____________。若将此针筒长时间放置,又可看到何种变化____________,试用平衡观点加以解释:_____________________________。
26、氯酸与亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如下图所示,又知这个反应速率随着溶液(H+)增大而加快。
(1)写出该反应的化学方程式______________。 (2)反应开始时速率加快的原因是______________。 (3)反应后期反应速率慢的原因是______________。
 27、一般来讲,绝大多数化学反应都有一定的可逆性,试回答:硫在盛纯氧的集气瓶中燃烧后,可能有少量SO3生成,则在盛空气的集气瓶中转化的SO2将更低,原因是______________________________。
27、一般来讲,绝大多数化学反应都有一定的可逆性,试回答:硫在盛纯氧的集气瓶中燃烧后,可能有少量SO3生成,则在盛空气的集气瓶中转化的SO2将更低,原因是______________________________。
1、下列说法是否正确?为什么?
(1)物质是由分子构成的,分子是保持物质化学性质的一种微粒。
(2)由同种元素组成的物质一定是单质。
(3)酸性氧化物都是酸酐,它们和水反应生成相应的酸。
(4)碱性氧化物肯定是金属氧化物,金属氧化物肯定是碱性氧化物。
(5)酸性氧化物肯定是非金属氧化物,非金属氧化物肯定是酸性氧化物。
(6)同种元素可有不同种原子,它们的化学性质几乎完全相同。
(7)具有相同质子数的微粒都属于同种元素。
(8)具有相同分子组成的化合物都属于同种物质。
(9)有新单质生成的化学反应,肯定属于氧化还原反应。
(10)既能跟酸反应,又能跟碱反应的化合物都属于两性化合物。
2、化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下测定)试回答:①A的化学式________,推断的理由是______________________________________。
②已知在A分子中,x个氧原子呈-O-O…链状排列,每一根短线代表一对共用电子,试写出A分子的电子式_______,A分子的结构式_______,并标出每一个原子的化合价_____。
3、根据你的理解,某种不溶于水的金属氧化物,如果要判别它是酸性氧化物、碱性氧化物,还是两性氧化物,其方法是_______________________。
4、4mLO2和3mLNxHy(y>x)混合气体在120℃,1.01×105Pa下点燃完全反应后,恢复到原温度和压强时,测得反应后N2、O2、H2O(气)混合气体密度减小3/10。
(1)反应的化学方程式为________________________。
(2)推算NxHy的化学式:
①计算的根据是(用文字叙述)__________________,即(用含有x、y的代数式表示)________________________。
②解方程得________________,当___________时合题意,所以NxHy的化学式为_______________________。
5、基于硫和硒的相似性及硫酸钾和硒酸钾晶型相同,1820年米希尔里希认为这两种盐组成相同。所以在已知硫原子相对原子质量(32)的前提下,根据下列数据求出硒的相对原子质量。硫酸钾中含:钾a%,硫b%,氧c%;硒酸钾中含:钾d%,硒e%,氧f%。
(1)判断硫或硒相对原子质量大的依据是_______________________。
(2)米希尔里希求硒的相对原子质量的计算式是_______________________。
6、溴蒸气密度几乎是氯气密度和碘蒸气密度的(数学)平均值(密度是在同温、同压下测定的)。由这个实验结果可知_____,能否用上述实验结果知道氯、溴、碘的化学式?
7、1892年拉姆塞和雷利发现了氩,他们从实验中发现氩是一种稀有气体,并测得相对原子质量为40.0。请你设计一个方案,证实它是单原子分子。
8、在天平的两个托盘上各放一个盛有等体积稀H2SO4的烧杯(每杯溶液中都含有mmol的H2SO4),调节天平使其平衡。然后在一个烧杯中加入ag铁粉,在另一个烧杯中加入bg镁粉,充分反应后,天平仍平衡。试用代数式表示在下列各种情况下,a与b的关系(关系式中可含m)。
(1)若a/56>m,b/24>m时,________________。
(2)若a/56<m,b/24<m时,_________________。
(3)若a/56<m,b/24>m时,_________________。
(4)若a/56>m,b/24<m时,天平能否平衡,说明理由__________________。
9、白色的亚铜化合物Cu(NH4)SO3难溶于水。若与足量的10mol/L的硫酸溶液混合并微热,生成铜和SO2气体及溶液。
(1)完成并配平化学方程式: (2)按上述操作,铜的最高转化率是_____。
(3)有人设计让上述反应在密闭容器中进行,结果铜的转化率大大提高。问在密闭容器中反应,铜的最高转化率是________,其理由________________。
10、已知:AgF + Cl2 + H2O
→ AgCl + AgClO3 + HF +
O2(未配平)。若Cl2系数为a,则AgF的系数为_______,判断的依据是________;若AgClO3的系数为b,O2系数为c,则AgCl的系数为________,判断的依据________________。
11、我国北方地区的某些小盐湖,冬天湖底有纯碱晶体析出,夏天偶尔可见有食盐晶体析出。简述其原因。
12、在饱和Na2CO3的溶液中通入足量的CO2会有晶体析出,此晶体是_______;析出此晶体的原因是因为_______________。在饱和食盐水中先通入足量的氨,再通入足量的CO2会有NaHCO3晶体析出;若在饱和食盐水中先通入足量CO2,再通入氨气往往没有晶体析出,原因是___________________________。
13、托盘天平的两盘分别放上盛MgCl2和Na2CO3晶体的表面皿,两者质量相等,然后用玻璃罩把整个托盘天平罩上。经过一段时间,托盘天平发生倾斜,这是因为_________________________________。
14、无水CaCl2可用作干燥剂。有人认为夏天用CaCl2水溶液代替自来水喷洒柏油马路会得到更好的效果。其原因是____________________________。
15、CaCl2和冰的混合物是实验室常用的致冷剂,可获得-55℃的低温。在配制冷冻剂时,采用CaCl2·6H2O好,还是采用无水CaCl2好?为什么?
16、向盛沸水的小烧杯中滴入FeCl3溶液,然后将此溶液倒入U形管里并加外电场,最后加MgCl2溶液于U形管里。
简述上面实验过程中发生的现象_________________________,
写出有关的化学方程式_______________________________。
17、实验时,手指不慎划破,可从急救箱中取出FeCl3溶液应急止血,其原理是_______________________________________。
18、1840年盖斯根据一系列实验事实得出规律,他指出“若一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同”参照它回答:
(1)使AgSO2和BgS在碱性溶液中作用,恰好完全反应生成
(2)按上述操作,铜的最高转化率是_____。
(3)有人设计让上述反应在密闭容器中进行,结果铜的转化率大大提高。问在密闭容器中反应,铜的最高转化率是________,其理由________________。
10、已知:AgF + Cl2 + H2O
→ AgCl + AgClO3 + HF +
O2(未配平)。若Cl2系数为a,则AgF的系数为_______,判断的依据是________;若AgClO3的系数为b,O2系数为c,则AgCl的系数为________,判断的依据________________。
11、我国北方地区的某些小盐湖,冬天湖底有纯碱晶体析出,夏天偶尔可见有食盐晶体析出。简述其原因。
12、在饱和Na2CO3的溶液中通入足量的CO2会有晶体析出,此晶体是_______;析出此晶体的原因是因为_______________。在饱和食盐水中先通入足量的氨,再通入足量的CO2会有NaHCO3晶体析出;若在饱和食盐水中先通入足量CO2,再通入氨气往往没有晶体析出,原因是___________________________。
13、托盘天平的两盘分别放上盛MgCl2和Na2CO3晶体的表面皿,两者质量相等,然后用玻璃罩把整个托盘天平罩上。经过一段时间,托盘天平发生倾斜,这是因为_________________________________。
14、无水CaCl2可用作干燥剂。有人认为夏天用CaCl2水溶液代替自来水喷洒柏油马路会得到更好的效果。其原因是____________________________。
15、CaCl2和冰的混合物是实验室常用的致冷剂,可获得-55℃的低温。在配制冷冻剂时,采用CaCl2·6H2O好,还是采用无水CaCl2好?为什么?
16、向盛沸水的小烧杯中滴入FeCl3溶液,然后将此溶液倒入U形管里并加外电场,最后加MgCl2溶液于U形管里。
简述上面实验过程中发生的现象_________________________,
写出有关的化学方程式_______________________________。
17、实验时,手指不慎划破,可从急救箱中取出FeCl3溶液应急止血,其原理是_______________________________________。
18、1840年盖斯根据一系列实验事实得出规律,他指出“若一个反应可以分几步进行,则各步反应的反应热总和与这个反应一次发生时的反应热相同”参照它回答:
(1)使AgSO2和BgS在碱性溶液中作用,恰好完全反应生成 ,若使BgS在碱性溶液中发生反应,生成S2-和
,若使BgS在碱性溶液中发生反应,生成S2-和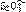 ,然后通AgSO2也生成
,然后通AgSO2也生成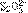 。各反应都相同条件下进行,则:
①反应热是否相同___________________。
②两种情况生成
。各反应都相同条件下进行,则:
①反应热是否相同___________________。
②两种情况生成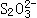 的物质的量是否相同__________,简述其理由________________。
(2)已知热化学方程式
C(固、金刚石) + O2(气) == CO2(气) + 395.41kJ
C(固、石墨) + O2(气) == CO2(气) + 393.51kJ
则金刚石转化为石墨时的热化学方程式为___________________;由热化方程式看来更稳定的碳的同素异形体是_____________________。
19、有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X,Y,Z。X,Y,Z之间也能相互发生反应,已知X是由a和b元素按原子个数比为1:1组成的化合物,其它元素形成的单质(仍用a,b,c表示)和组成的化合物之间反应关系如下(未配平)
①b + c → Y ②a + c → Z ③X + Y → m
④X + Z → C + n ⑤Y + Z → C + n
回答下列问题
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是_________,其充分理由是_____________________________________。
(2)如果m是一种无色、粘稠的油状液体化合物,则X、Y、Z分别为______________,写出③④两反应的化学方程式_______________________,______________。
20、有原子序数依次增大的A,B,C,D,E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
的物质的量是否相同__________,简述其理由________________。
(2)已知热化学方程式
C(固、金刚石) + O2(气) == CO2(气) + 395.41kJ
C(固、石墨) + O2(气) == CO2(气) + 393.51kJ
则金刚石转化为石墨时的热化学方程式为___________________;由热化方程式看来更稳定的碳的同素异形体是_____________________。
19、有a、b、c三种常见的短周期元素,它们之间两两结合构成化合物X,Y,Z。X,Y,Z之间也能相互发生反应,已知X是由a和b元素按原子个数比为1:1组成的化合物,其它元素形成的单质(仍用a,b,c表示)和组成的化合物之间反应关系如下(未配平)
①b + c → Y ②a + c → Z ③X + Y → m
④X + Z → C + n ⑤Y + Z → C + n
回答下列问题
(1)最有充分理由说明上述反应中一定属于氧化还原反应的是_________,其充分理由是_____________________________________。
(2)如果m是一种无色、粘稠的油状液体化合物,则X、Y、Z分别为______________,写出③④两反应的化学方程式_______________________,______________。
20、有原子序数依次增大的A,B,C,D,E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中
各元素原
子个数比 |
A:C=
1:1 |
B:A=
1:2 |
D:E=
1:3 |
B:E=
1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同一周期,且D和E的原子序数之和为30。 (1)D和E同属哪一周期元素?推断依据是________________________。 (2)根据题目提供的条件,推断在周期表中的族序数所必要的条件是___________。 (3)向甲的水溶液中加MnO2,反应的化学方程式:____________________。 (4)已知乙的相对分子质量小于甲。在实验室常用什么方法制得乙?_____________。 (5)丙的水溶液呈酸性,与饱和的NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是________________________________。
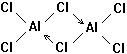 21、(1)已知气态氯化铝分子以双聚形
式存在,其中Al-Cl键为共价键,其结构式
如图所示。图中“Cl→Al;”表示Cl原子提
21、(1)已知气态氯化铝分子以双聚形
式存在,其中Al-Cl键为共价键,其结构式
如图所示。图中“Cl→Al;”表示Cl原子提
供了一对电子与Al原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。可以用硼酸在水溶液中的电离平衡解释它只是一元酸的原因。请写出下面方程式右端的两种离子的表达式:
 (1)化工行业合成一种原子晶体--氮化碳,推测其化学式为__________,其硬度比金刚石______(填“大”或“小”),因为_____________________。
(1)化工行业合成一种原子晶体--氮化碳,推测其化学式为__________,其硬度比金刚石______(填“大”或“小”),因为_____________________。
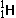 和
和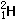 属于同种元素,
属于同种元素,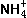 和Na+具有相同质子数,就不属于同种元素。
(8)不正确,例如乙醇(CH3CH2OH)和甲醚(CH3OCH3),它们的分子组成相同,均为C2H6O,但它们互为同分异构体,不属于同种物质。
(9)不正确。同素异形体间的相互转变,如O2变为O3,或O3变为O2,都是有单质生成的反应,却不属于氧化还原反应。
(10)不正确。弱酸的酸式盐NaHCO3,既可与酸反应放出CO2,又可与碱反应生成Na2CO3和水,但不是两性化合物。只有Al2O3、Al(OH)3、NH2CH2COOH等化合物才是两性化合物。
2、①O3F2。根据阿伏加德罗定律,A物质分解反应的化学方程式为:2A =
3O2 + 2F2根据质量守恒定律,A分子组成应为O3F2。
和Na+具有相同质子数,就不属于同种元素。
(8)不正确,例如乙醇(CH3CH2OH)和甲醚(CH3OCH3),它们的分子组成相同,均为C2H6O,但它们互为同分异构体,不属于同种物质。
(9)不正确。同素异形体间的相互转变,如O2变为O3,或O3变为O2,都是有单质生成的反应,却不属于氧化还原反应。
(10)不正确。弱酸的酸式盐NaHCO3,既可与酸反应放出CO2,又可与碱反应生成Na2CO3和水,但不是两性化合物。只有Al2O3、Al(OH)3、NH2CH2COOH等化合物才是两性化合物。
2、①O3F2。根据阿伏加德罗定律,A物质分解反应的化学方程式为:2A =
3O2 + 2F2根据质量守恒定律,A分子组成应为O3F2。
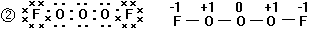 3、不溶于酸,能溶于碱生成盐和水的金属氧化物是酸性氧化物;不溶于碱,能溶于酸生成盐和水的氧化物是碱性氧化物;既能溶于酸又能溶于碱且生成盐和水的金属氧化物是两性氧化物。
3、不溶于酸,能溶于碱生成盐和水的金属氧化物是酸性氧化物;不溶于碱,能溶于酸生成盐和水的氧化物是碱性氧化物;既能溶于酸又能溶于碱且生成盐和水的金属氧化物是两性氧化物。
 (2)①反应前后质量不变,同温同压时气体密度与气体体积成反比
(2)①反应前后质量不变,同温同压时气体密度与气体体积成反比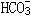 浓度低。
13、Na2CO3晶体易失水风化使其质量减轻,MgCl2晶体易吸水潮解使其质量增重。
14、夏天气温高,路面喷洒的水易蒸发,若喷洒CaCl2水溶液,水蒸发后,因CaCl2具有强吸水性,能从空气中吸收水分使路面保持湿润。
15、用CaCl2·6H2O更好,因无水CaCl2水合时要放出热量,降低致冷效果。
16、有红褐色胶体
浓度低。
13、Na2CO3晶体易失水风化使其质量减轻,MgCl2晶体易吸水潮解使其质量增重。
14、夏天气温高,路面喷洒的水易蒸发,若喷洒CaCl2水溶液,水蒸发后,因CaCl2具有强吸水性,能从空气中吸收水分使路面保持湿润。
15、用CaCl2·6H2O更好,因无水CaCl2水合时要放出热量,降低致冷效果。
16、有红褐色胶体 ,发生了电泳和凝聚。
17、FeCl3是电解质,它使血液中的蛋白质胶体很快凝结而止血。
18、(1)相同 (2)相同。因反应物的始态均相同,且终态产物也完全相同,虽过程不同,但根据盖斯定律热量相同,故两种情况下生成的
,发生了电泳和凝聚。
17、FeCl3是电解质,它使血液中的蛋白质胶体很快凝结而止血。
18、(1)相同 (2)相同。因反应物的始态均相同,且终态产物也完全相同,虽过程不同,但根据盖斯定律热量相同,故两种情况下生成的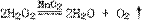
 氮原子半径<碳原子半径,C-N键长<C-C键长,C-N键强度>C-C键强度。
22、(1)C;(2)对,从反应②③可看出碘在反应中没有消耗(质量和化学性质均不变),在碘的存在下过氧化氢分解放出氧气的速率加快。(3)HIO>H2O2>I2。
23、①a>4k ②D。
24、(1)两组物质的熔点从左到右第Ⅰ组降低,第Ⅱ组升高,且第Ⅰ组普遍高于第Ⅱ组。
(2)第Ⅰ组均是离子晶体,第Ⅱ组都是分子晶体,Ⅰ组从左到右Na+→Cs+半径增大,键能减小,Ⅱ组组成结构相似,分子量增大,熔点升高。
25、气体体积缩小,溶液呈浅绿色 气体和溶液均变为无色氯水中有如下平衡
氮原子半径<碳原子半径,C-N键长<C-C键长,C-N键强度>C-C键强度。
22、(1)C;(2)对,从反应②③可看出碘在反应中没有消耗(质量和化学性质均不变),在碘的存在下过氧化氢分解放出氧气的速率加快。(3)HIO>H2O2>I2。
23、①a>4k ②D。
24、(1)两组物质的熔点从左到右第Ⅰ组降低,第Ⅱ组升高,且第Ⅰ组普遍高于第Ⅱ组。
(2)第Ⅰ组均是离子晶体,第Ⅱ组都是分子晶体,Ⅰ组从左到右Na+→Cs+半径增大,键能减小,Ⅱ组组成结构相似,分子量增大,熔点升高。
25、气体体积缩小,溶液呈浅绿色 气体和溶液均变为无色氯水中有如下平衡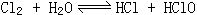 ,由于HClO逐渐分解,平衡不断右移,最终Cl2耗尽而转化为O2,导致气体体积缩小和黄绿色消失。
26、①反应开始时,2KClO3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,由于H2SO4[H+]增大,浓度减小,速度减慢。
27、S燃烧时主要生成SO2,在高温情况下可有少量2SO2+O2=2SO3+Q发生,但该反应系放热反应,温度高不利于SO3的生成,纯氧中单位时间内燃烧放出的热量多,温度高,因此SO2的转化率将更低。
28、反应放热,溶液温度升高,反应速率加快,盐酸浓度减小,反应速率减慢。
29、增加,加入含37Cl较多的Cl2后,平衡左移,虽未重新建立平衡,但37Cl较多的PCl5也在分解,所以,PCl3中,37Cl的百分含量也会增加。
30、D 由于气体分子数目和质量同时变化。即增大压强平衡向逆反应方向移动,产生了C(固),从而气体的质量减小,而气体的物质的量也减小了 5z≤3x+8y。
31、(1)在850℃时,KCl、NaCl、Na均为液态,只有K为气态。(2)依据平衡移动原理,将K变为气态脱离反应条件,减少了生成物浓度,使可逆反应不断向正方向移动。
32、(1)放热反应 (2)在500℃以下时,反应并未达到平衡,正反应速度始终大于逆反应速度,所以温度升高,混合物(非平衡状态)中C的百分含量也增大。
(3)在500℃以上时,反应处于平衡状态后的移动。因为正反应是放热反应,所以温度升高,平衡向逆反应方向移动,平衡时混合物中C的百分含量逐渐减少。
33、(1)1,1,2,1,4;(2)温度升高,反应速度增大
(3)增大,NaNO2是反应物中的氧化剂,增大反应物浓度,平衡向生成物方向移动;由③知,增大NaOH浓度,平衡向逆方向移动,抑制Fe3O4的生成。
34、可以,由于该反应是一个反应前后气体体积不变的反应,压强增大到2倍时,I2(气)及其它物质的物质的量均不变,但浓度却增大到2倍,故可以看到I2(气)的紫色加深。
35、合成氨的反应是一个气体体积减小的反应,高压有利于平衡向右移动,而制SO3反应
,由于HClO逐渐分解,平衡不断右移,最终Cl2耗尽而转化为O2,导致气体体积缩小和黄绿色消失。
26、①反应开始时,2KClO3+6NaHSO3==3Na2SO4+2KCl+3H2SO4,由于H2SO4[H+]增大,浓度减小,速度减慢。
27、S燃烧时主要生成SO2,在高温情况下可有少量2SO2+O2=2SO3+Q发生,但该反应系放热反应,温度高不利于SO3的生成,纯氧中单位时间内燃烧放出的热量多,温度高,因此SO2的转化率将更低。
28、反应放热,溶液温度升高,反应速率加快,盐酸浓度减小,反应速率减慢。
29、增加,加入含37Cl较多的Cl2后,平衡左移,虽未重新建立平衡,但37Cl较多的PCl5也在分解,所以,PCl3中,37Cl的百分含量也会增加。
30、D 由于气体分子数目和质量同时变化。即增大压强平衡向逆反应方向移动,产生了C(固),从而气体的质量减小,而气体的物质的量也减小了 5z≤3x+8y。
31、(1)在850℃时,KCl、NaCl、Na均为液态,只有K为气态。(2)依据平衡移动原理,将K变为气态脱离反应条件,减少了生成物浓度,使可逆反应不断向正方向移动。
32、(1)放热反应 (2)在500℃以下时,反应并未达到平衡,正反应速度始终大于逆反应速度,所以温度升高,混合物(非平衡状态)中C的百分含量也增大。
(3)在500℃以上时,反应处于平衡状态后的移动。因为正反应是放热反应,所以温度升高,平衡向逆反应方向移动,平衡时混合物中C的百分含量逐渐减少。
33、(1)1,1,2,1,4;(2)温度升高,反应速度增大
(3)增大,NaNO2是反应物中的氧化剂,增大反应物浓度,平衡向生成物方向移动;由③知,增大NaOH浓度,平衡向逆方向移动,抑制Fe3O4的生成。
34、可以,由于该反应是一个反应前后气体体积不变的反应,压强增大到2倍时,I2(气)及其它物质的物质的量均不变,但浓度却增大到2倍,故可以看到I2(气)的紫色加深。
35、合成氨的反应是一个气体体积减小的反应,高压有利于平衡向右移动,而制SO3反应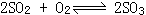 尽管也是一个气体体积减小的反应,但在常压下SO2的转化率已经较高。
36、V1≠V2 增大Ag+或Ac-的浓度,都有使平衡向正反应方向移动,降低AgAc的溶解度。
37、(1)增加;(2)加水,加AgNO3溶液。
38、①黄色;②橙红色;③向右移动,变为无色。
39、在MgCl2溶液中加入氨水时,产生的白沉淀是Mg(OH)2。Mg(OH)2是不溶于水的,在溶液中有溶解平衡、电离平衡同时存在,
尽管也是一个气体体积减小的反应,但在常压下SO2的转化率已经较高。
36、V1≠V2 增大Ag+或Ac-的浓度,都有使平衡向正反应方向移动,降低AgAc的溶解度。
37、(1)增加;(2)加水,加AgNO3溶液。
38、①黄色;②橙红色;③向右移动,变为无色。
39、在MgCl2溶液中加入氨水时,产生的白沉淀是Mg(OH)2。Mg(OH)2是不溶于水的,在溶液中有溶解平衡、电离平衡同时存在,
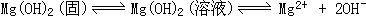 。当分别加入NH4Cl、CH3COONH4、NaHCO3、NH4HCO3等强电解质后,
。当分别加入NH4Cl、CH3COONH4、NaHCO3、NH4HCO3等强电解质后,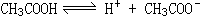 ,溶液中产生自由移动的离子,导电性逐渐增大。继续稀释,电离度略有增大,但溶液体积增大,离子浓度反而降低,导电性减弱。当加入NaOH溶液时由于发生中和反应,生成强电解质CH3COONa,CH3COONa在溶液中完全电离,使离子浓度增大,因此导电性增强。
41、(1)a=[H+]/c=10-3/0.2=0.5% (2)NH3·H2O和CH3COOH为弱电解质,但NH3·H2O+CH3COOH=CH3COONH4+H2O,其中CH3COOH为强电解质,随CH3COONH4的量的增加,溶液的导电性逐渐增强,当氨水和醋酸恰好反应时,溶液的导电性最强,继续加氨水,溶液体积变大,会使离子浓度下降,使导电性减弱。
42、(1)< 两溶液稀释相同的倍数后,由于强酸完全电离,B中的H+数目不会变,强酸稀释后电离度增大,使A中的H+数目增大。因开始时,A、B的pH值相等,故稀释后pH(A)<pH(B);
(2)< 中和反应的实质是H++OH-==H2O。因稀释后A中的[H+]比B中的[H+]大,且A中未电离的一元弱酸分子也可(继续电离出H+)与NaOH溶液中和,故需B的体积大。
43、已知室温时,纯水中的[H+]=[OH-]=10-7mol/L,又因水的离解
,溶液中产生自由移动的离子,导电性逐渐增大。继续稀释,电离度略有增大,但溶液体积增大,离子浓度反而降低,导电性减弱。当加入NaOH溶液时由于发生中和反应,生成强电解质CH3COONa,CH3COONa在溶液中完全电离,使离子浓度增大,因此导电性增强。
41、(1)a=[H+]/c=10-3/0.2=0.5% (2)NH3·H2O和CH3COOH为弱电解质,但NH3·H2O+CH3COOH=CH3COONH4+H2O,其中CH3COOH为强电解质,随CH3COONH4的量的增加,溶液的导电性逐渐增强,当氨水和醋酸恰好反应时,溶液的导电性最强,继续加氨水,溶液体积变大,会使离子浓度下降,使导电性减弱。
42、(1)< 两溶液稀释相同的倍数后,由于强酸完全电离,B中的H+数目不会变,强酸稀释后电离度增大,使A中的H+数目增大。因开始时,A、B的pH值相等,故稀释后pH(A)<pH(B);
(2)< 中和反应的实质是H++OH-==H2O。因稀释后A中的[H+]比B中的[H+]大,且A中未电离的一元弱酸分子也可(继续电离出H+)与NaOH溶液中和,故需B的体积大。
43、已知室温时,纯水中的[H+]=[OH-]=10-7mol/L,又因水的离解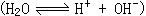 是吸热反应,故温度升高到80℃,电离度增大,致使[H+]=[OH-]>10-7mol/L,即pH<7。
44、(1)不正确。
(2)若溶液不显中性,则H+或OH-被稀释,测出的不为溶液中H+或OH-对应的pH值;可能有误差,当溶液为中性时则不产生误差。
(3)测得的pH值H3PO4较H2SO4小,因为在稀释过程中,H3PO4继续电离产生H+,使得其溶液中[H+]较H2SO4溶液的[H+]大。
45、有 例如稀释盐酸,溶液中[OH-]增大。
46、减小 NaOH与空气中的CO2反应,造成NaOH浓度减少,故溶液的pH值减小。(1)VA=VB (2)VA<VB
47、①K2CO3;尽管加热过程促进K2CO3水解,但随着水的挥发,生成KHCO3和KOH反应后仍为K2CO3;
②明矾;尽管Al3+水解。由于H2SO4为高沸点酸,故最后仍然是结晶水合物明矾;
③Mg(OH)2;Mg(HCO3)2在溶液中受热分解,生成的MgCO3在溶液中受热水解生成Mg(OH)2沉淀。
④Na2SO4和Na2SO3混合物;Na2SO3在蒸干的过程中不断被空气中氧气氧化而变成Na2SO4;
⑤Al(OH)3和Al2O3;Al3+水解,HCl挥发,得Al(OH)3,Al(OH)3部分分解为Al2O3;
⑥10mol/LH2SO4溶液;HCl挥发后剩余为硫酸溶液。
48、(1)NaOH、HNO3。 NaNO2、NH4NO3。
(2)由于HNO3在溶液电离出H+,使水的电离平衡
是吸热反应,故温度升高到80℃,电离度增大,致使[H+]=[OH-]>10-7mol/L,即pH<7。
44、(1)不正确。
(2)若溶液不显中性,则H+或OH-被稀释,测出的不为溶液中H+或OH-对应的pH值;可能有误差,当溶液为中性时则不产生误差。
(3)测得的pH值H3PO4较H2SO4小,因为在稀释过程中,H3PO4继续电离产生H+,使得其溶液中[H+]较H2SO4溶液的[H+]大。
45、有 例如稀释盐酸,溶液中[OH-]增大。
46、减小 NaOH与空气中的CO2反应,造成NaOH浓度减少,故溶液的pH值减小。(1)VA=VB (2)VA<VB
47、①K2CO3;尽管加热过程促进K2CO3水解,但随着水的挥发,生成KHCO3和KOH反应后仍为K2CO3;
②明矾;尽管Al3+水解。由于H2SO4为高沸点酸,故最后仍然是结晶水合物明矾;
③Mg(OH)2;Mg(HCO3)2在溶液中受热分解,生成的MgCO3在溶液中受热水解生成Mg(OH)2沉淀。
④Na2SO4和Na2SO3混合物;Na2SO3在蒸干的过程中不断被空气中氧气氧化而变成Na2SO4;
⑤Al(OH)3和Al2O3;Al3+水解,HCl挥发,得Al(OH)3,Al(OH)3部分分解为Al2O3;
⑥10mol/LH2SO4溶液;HCl挥发后剩余为硫酸溶液。
48、(1)NaOH、HNO3。 NaNO2、NH4NO3。
(2)由于HNO3在溶液电离出H+,使水的电离平衡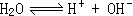 向逆方向移动,故水的电离度减小。而NH4NO3在溶液中电离出的
向逆方向移动,故水的电离度减小。而NH4NO3在溶液中电离出的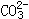 转化为1molCO2需2molH+,H+由Al3+提供,现因Al3+量不变,只能生成
转化为1molCO2需2molH+,H+由Al3+提供,现因Al3+量不变,只能生成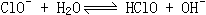 ,使铝溶解,此外HClO的强氧化性也能氧化铝。
54、(1)D; (2)加入CuSO4后,构成Fe-Ag原电池,Fe溶解,减轻,Cu2+在银圈上得电子,沉积在其上,增重。
55、(1)甲=乙=丙;(2)甲=乙<丙;(3)甲>乙>丙;
(4)对于丙,形成Zn-Cu原电池,使反应速率加快。
56、钢铁在通常情况下易发生的是吸氧腐蚀,Na2SO3具有较强的还原性,能与水中溶解的氧反应:2Na2SO3+O2==2Na2SO4防止输水管发生吸氧腐蚀。
57、化学腐蚀,2Al+6CH3COOH==2Al(Ac)3+3H2↑;电化学腐蚀,负极:Al-3e==Al3+,正极:O2+2H2O+4e==4OH-
58、(1)保持铁不被腐蚀;
(2)防止空气中的O2进入氧化Fe2+;
(3)开始形成原电池,且[H+]大,反应速度快,随着反应进行,Zn溶解。[H+]减小,反应速率减慢;
(4)使Zn(OH)2溶解而与Fe(OH)3分离;
(5)16%。
59、Al-3e==Al3+ Ag2S+2e==2Ag+S2-
2Al+3Ag2S+6H2O==2Al(OH)3↓+6Ag+2H2S↑
60、(1)Fe-2e==Fe2+ 2H++2e=H2↑;
,使铝溶解,此外HClO的强氧化性也能氧化铝。
54、(1)D; (2)加入CuSO4后,构成Fe-Ag原电池,Fe溶解,减轻,Cu2+在银圈上得电子,沉积在其上,增重。
55、(1)甲=乙=丙;(2)甲=乙<丙;(3)甲>乙>丙;
(4)对于丙,形成Zn-Cu原电池,使反应速率加快。
56、钢铁在通常情况下易发生的是吸氧腐蚀,Na2SO3具有较强的还原性,能与水中溶解的氧反应:2Na2SO3+O2==2Na2SO4防止输水管发生吸氧腐蚀。
57、化学腐蚀,2Al+6CH3COOH==2Al(Ac)3+3H2↑;电化学腐蚀,负极:Al-3e==Al3+,正极:O2+2H2O+4e==4OH-
58、(1)保持铁不被腐蚀;
(2)防止空气中的O2进入氧化Fe2+;
(3)开始形成原电池,且[H+]大,反应速度快,随着反应进行,Zn溶解。[H+]减小,反应速率减慢;
(4)使Zn(OH)2溶解而与Fe(OH)3分离;
(5)16%。
59、Al-3e==Al3+ Ag2S+2e==2Ag+S2-
2Al+3Ag2S+6H2O==2Al(OH)3↓+6Ag+2H2S↑
60、(1)Fe-2e==Fe2+ 2H++2e=H2↑;
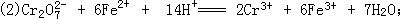 3)H+不断放电,
3)H+不断放电,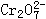 与Fe2+反应中消耗H+,打破了水的电离平衡,使溶液中的[OH-]>[H+];
(4)不能。因为用石墨作电极,阳极产生Cl2,得不到Fe2+缺少还原剂,不能使
与Fe2+反应中消耗H+,打破了水的电离平衡,使溶液中的[OH-]>[H+];
(4)不能。因为用石墨作电极,阳极产生Cl2,得不到Fe2+缺少还原剂,不能使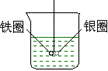 A 铁圈和银圈左右摇摆不定
B 保持平衡状态不变
C 铁圈向下倾斜
D 银圈向下倾斜
(2) 产生上述现象的原因是_____________________。
55、称取三份锌粉,分盛三支试管中,按下列要求另加物质后,塞上导管塞子,定时间测定生成氢气体积。试管甲加入pH=3的盐酸50mL,乙加入pH=3的醋酸50mL,丙加pH=3的醋酸50mL及少量胆矾粉末。若反应终了,生成氢气一样多,且没有剩余的锌,请用>、=、<回答:
(1)开始时反应速率的大小为__________________。
(2)三支试管中参加反应的锌的质量___________________。
(3)反应终了,所需时间是_________________________。
(4)简要说明在反应过程中乙、丙速率不同的理由是__________________。
56、在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说明原因______________________。
57、铝制饭盒盛放醋酸一段时间后饭盒被腐蚀,该种腐蚀属_______,反应的化学方程式表示为_______________;若用铝饭盒盛放食盐(含水时)一段时间后,饭盒被腐蚀,这种腐蚀叫做_____________,反应原理是(写离子方程式)_______________。
58、实验室分析白铁(镀锌)样品成分,称取1.00g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后完全反应。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。试回答:(1)白铁镀锌的作用是_________。(2)盖玻璃片的作用是_______。(3)放出气体速率由快变慢的原因是_______。(4)为什么要加入过量NaOH溶液_______。
(5)锌在样品中的百分含量是______________。
59、银器皿日久表面逐渐变黑色,这是由于生成硫化银。有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为____________;正极发生的反应为__________________;反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为_________________________。
60、工业上为了处理含
A 铁圈和银圈左右摇摆不定
B 保持平衡状态不变
C 铁圈向下倾斜
D 银圈向下倾斜
(2) 产生上述现象的原因是_____________________。
55、称取三份锌粉,分盛三支试管中,按下列要求另加物质后,塞上导管塞子,定时间测定生成氢气体积。试管甲加入pH=3的盐酸50mL,乙加入pH=3的醋酸50mL,丙加pH=3的醋酸50mL及少量胆矾粉末。若反应终了,生成氢气一样多,且没有剩余的锌,请用>、=、<回答:
(1)开始时反应速率的大小为__________________。
(2)三支试管中参加反应的锌的质量___________________。
(3)反应终了,所需时间是_________________________。
(4)简要说明在反应过程中乙、丙速率不同的理由是__________________。
56、在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说明原因______________________。
57、铝制饭盒盛放醋酸一段时间后饭盒被腐蚀,该种腐蚀属_______,反应的化学方程式表示为_______________;若用铝饭盒盛放食盐(含水时)一段时间后,饭盒被腐蚀,这种腐蚀叫做_____________,反应原理是(写离子方程式)_______________。
58、实验室分析白铁(镀锌)样品成分,称取1.00g样品放在烧杯中,加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后完全反应。接着加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。试回答:(1)白铁镀锌的作用是_________。(2)盖玻璃片的作用是_______。(3)放出气体速率由快变慢的原因是_______。(4)为什么要加入过量NaOH溶液_______。
(5)锌在样品中的百分含量是______________。
59、银器皿日久表面逐渐变黑色,这是由于生成硫化银。有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为____________;正极发生的反应为__________________;反应过程中产生臭鸡蛋气味的气体,原电池总反应方程式为_________________________。
60、工业上为了处理含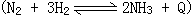 采用高压条件下进行;接触法制硫酸工业
采用高压条件下进行;接触法制硫酸工业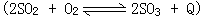 采用常压条件下进行,其理由是______。
36、难溶的银盐中,醋酸银(AgAc)溶解度相对较大。当V1mL,2mol/LNaAc溶液和V2mL,2mol/L AgNO3溶液混合发生反应时,欲使得到AgAc的沉淀量较接近理论值,则V1和V2的关系是_______________。简述理由:__________________。
37、(1)在
采用常压条件下进行,其理由是______。
36、难溶的银盐中,醋酸银(AgAc)溶解度相对较大。当V1mL,2mol/LNaAc溶液和V2mL,2mol/L AgNO3溶液混合发生反应时,欲使得到AgAc的沉淀量较接近理论值,则V1和V2的关系是_______________。简述理由:__________________。
37、(1)在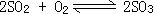 的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O的含量____________(填增加、减少或不变),其原因______________。
(2)CuCl2溶液Z有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O的含量____________(填增加、减少或不变),其原因______________。
(2)CuCl2溶液Z有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
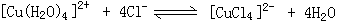 现欲使溶液由黄色变成黄绿色,请写出两种可采用的方法:
①____________________②____________________。
38、在水溶液中橙红色的
现欲使溶液由黄色变成黄绿色,请写出两种可采用的方法:
①____________________②____________________。
38、在水溶液中橙红色的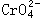 有平衡关系:
有平衡关系:
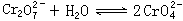 。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
①向上述溶液中加入NaOH溶液,溶液呈________色,因为________。②向已加入NaOH溶液的①中再加入过量稀硫酸,则溶液应是____色,因为_________;③向原溶液中加入硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡_________,溶液颜色将_____________。
39、在MgCl2溶液中加入氨水,立即产生白色沉淀,待沉淀完全后,将沉淀分装在四支
。把重铬酸钾(K2Cr2O7)溶于水配成稀溶液呈橙色。
①向上述溶液中加入NaOH溶液,溶液呈________色,因为________。②向已加入NaOH溶液的①中再加入过量稀硫酸,则溶液应是____色,因为_________;③向原溶液中加入硝酸钡溶液(已知BaCrO4为黄色沉淀),则平衡_________,溶液颜色将_____________。
39、在MgCl2溶液中加入氨水,立即产生白色沉淀,待沉淀完全后,将沉淀分装在四支 试管中,往其中分别加入足量的NH4Cl、CH3COONH4、NaHCO3、NH4HCO3的浓溶液,均可使白色沉淀溶解,其原因是______________________。
40、冰醋酸不导电。慢慢加入少量水稀释,溶液导电性逐渐增强;当加入较多量水时溶液导电性减弱,再加入含相等物质的量的NaOH溶液,溶液导电性又增强。试解释以上事实。
41、在某装置中有20mLpH=3的醋酸溶液,逐
试管中,往其中分别加入足量的NH4Cl、CH3COONH4、NaHCO3、NH4HCO3的浓溶液,均可使白色沉淀溶解,其原因是______________________。
40、冰醋酸不导电。慢慢加入少量水稀释,溶液导电性逐渐增强;当加入较多量水时溶液导电性减弱,再加入含相等物质的量的NaOH溶液,溶液导电性又增强。试解释以上事实。
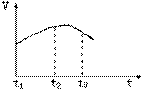
41、在某装置中有20mLpH=3的醋酸溶液,逐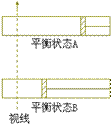 600K时,在容积可变的透明容器内,反应
600K时,在容积可变的透明容器内,反应 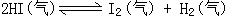 达到平
衡状态A。保持温度不变,将容器的容积
压缩成为原容积的一半,达到平衡状态
B。按右图所示的观察方向,能否看出两
次平衡时容器内气体颜色的深浅变化?并
达到平
衡状态A。保持温度不变,将容器的容积
压缩成为原容积的一半,达到平衡状态
B。按右图所示的观察方向,能否看出两
次平衡时容器内气体颜色的深浅变化?并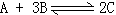 ,在反应过程中C的百分含量C%与温度的关
,在反应过程中C的百分含量C%与温度的关  系如右图。
(1)该反应是(吸热、放热)___________反应。
(2)温度t<500℃时,C%逐渐增大的原因_____。
(3)温度t>500℃时,C%逐渐减少的原因是_____。
系如右图。
(1)该反应是(吸热、放热)___________反应。
(2)温度t<500℃时,C%逐渐增大的原因_____。
(3)温度t>500℃时,C%逐渐减少的原因是_____。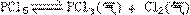 处于平衡状态时,向其中加入一种37Cl含量较高的氯气,平衡发生移动,在建立新平衡以前,PCl3所含37Cl的百分含量比原平衡状态时是否会增加?请说明理由_______________________。
30、对于可逆反应:
处于平衡状态时,向其中加入一种37Cl含量较高的氯气,平衡发生移动,在建立新平衡以前,PCl3所含37Cl的百分含量比原平衡状态时是否会增加?请说明理由_______________________。
30、对于可逆反应: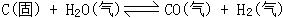 达到平衡后,增大压强(反应在密闭容器中进行),平衡混合气的平均相对分子质量_________(填A、增大,B、减小,C、不变,D、可能增大也可能减小或不变),其原因是____________________。如果设平衡时H2O(气)、CO(气)、H2(气)的物质的量分别为X、Y、Zmol,则要使平衡时混合气体的平均相对分子质量增大或不变,则X、Y、Z必须满足的关系式是__________。
31、工业上生产钾是用金属钠与熔化的KCl反应制取,反应式如下:
达到平衡后,增大压强(反应在密闭容器中进行),平衡混合气的平均相对分子质量_________(填A、增大,B、减小,C、不变,D、可能增大也可能减小或不变),其原因是____________________。如果设平衡时H2O(气)、CO(气)、H2(气)的物质的量分别为X、Y、Zmol,则要使平衡时混合气体的平均相对分子质量增大或不变,则X、Y、Z必须满足的关系式是__________。
31、工业上生产钾是用金属钠与熔化的KCl反应制取,反应式如下:
 (1)为什么选用850℃作为反应的适宜条件?其主要原因是_____________。
(2)工业制钾主要应用____________________原理,使可逆反应变为现实。
(1)为什么选用850℃作为反应的适宜条件?其主要原因是_____________。
(2)工业制钾主要应用____________________原理,使可逆反应变为现实。