28.煤粉在隔绝空气中加强热,除主要得到焦炭外,还能得到下表所列的物质:
|
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
名称 |
甲烷 |
一氧化碳 |
乙烯 |
苯 |
甲苯 |
苯酚 |
氨水 |
(1)表中所列物质不属于有机物的是(填序号): 。
(2)能使溴水褪色的是(填序号): 。
(3)能发生加聚反应、生成物可用作制造食品包装袋的是(填序号) ,该物质发生加聚反应的化学方程式为: 。
(4)能使氯化铁溶液变为紫色的是(填序号): 。
(5)甲苯的一氯取代产物的有 种。
23.(B)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其他元素的电负性。Linus Pauling建立的主族元素的电负性如下:
|
H:2.1 |
|
|
|
|
|
|
|
Li:1.0 |
Be:1.5 |
B:2.0 |
C:2.5 |
N:3.0 |
O:3.5 |
F:4.0 |
|
Na:0.9 |
Mg:1.2 |
Al:1.5 |
Si:1.8 |
P:2.1 |
S:2.5 |
Cl:3.0 |
|
K:0.8 |
Ca:1.0 |
Ga:1.6 |
Ge:1.8 |
As:2.0 |
Se:2.4 |
Br:2.8 |
|
Rb:0.8 |
Sr:1.0 |
In:1.7 |
Sn:1.8 |
Sb:1.9 |
Te:χ |
I:2.5 |
|
Cs:0.7 |
Ba:0.9 |
Tl:1.8 |
Pb:1.9 |
Bi:1.9 |
Po:2.0 |
At:2.2 |
|
Fr:0.7 |
Ra:0.9 |
|
|
|
|
|
回答下列问题:
⑴写出上述元素电负性在同周期或同主族中的递变规律(任定一种): 。
⑵ 预测Te元素χ的值 ,它的非金属性比I元素 (填“强”或“弱”) 。
⑶ 你认为Linus Pauling提出电负性的概念是确定化合物中原子 (填“失电子”、“得电子”)能力的相对大小。
⑷ 大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律, AlCl3中的化学键类型应该是 。
23.(A) 有四种同族物质,它们的沸点(℃,1.01×105 Pa)如下表所示:
|
① |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(a) 58.7 |
I2 184.0 |
|
③ |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O (z) |
H2S -60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答:
⑴ a为 色液体;b的分子式是: 。
⑵ 写出②系列中物质主要化学性质的递变规律(任定一种): ;能够说明该递变规律的化学事实是(任举一例,用离子方程式表示): ;
⑶ 除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是: 。
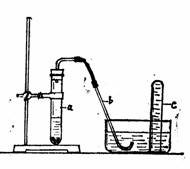 (2)拔开试管的橡皮塞,加入10 mL 6
mol/L稀
(2)拔开试管的橡皮塞,加入10 mL 6
mol/L稀 FeS(固)+ H2SO4(稀)
FeSO4 + H 2S↑
FeS(固)+ H2SO4(稀)
FeSO4 + H 2S↑

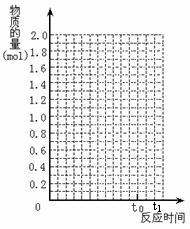 将2
mol SO2和1 mol O2混合置于体积可变
将2
mol SO2和1 mol O2混合置于体积可变 2SO3(g) +Q(Q>0)
2SO3(g) +Q(Q>0)
 NaNO2 + HI
NO + I2 + NaI + H2O
NaNO2 + HI
NO + I2 + NaI + H2O 第Ⅰ卷答题栏
第Ⅰ卷答题栏