11.硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为___________L。(已知:4FeS2
+ 11O2 2Fe2O3 + 8SO2)
2Fe2O3 + 8SO2)
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH溶液的体积/mL |
氨气的体积/L |
|
1 |
3.62 |
50.00 |
0.896 |
|
2 |
7.24 |
50.00 |
1.792 |
|
3 |
10.86 |
50.00 |
2.016 |
|
4 |
14.48 |
50.00 |
1.568 |
⑴由1组数据直接推测:1. 81 g样品进行同样实验时,生成氨气的体积(标准状况)为__________L。
⑵试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
⑶求所用NaOH溶液的物质的量浓度。(写出计算过程)
12测定水中溶解氧气的方法是:取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子、振荡,使反应充分;开塞,迅速加入适量H2SO4,此时有I2生成;用Na2S2O3溶液(浓度b mol·L-1)和I2反应,消耗了V mL达到终点(以淀粉作指示剂)。有关方程式为:
①2Mn2++O2+4OH-===2MnO(OH)2(反应很快)②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
③I2+2S2O32-===S4O62-+2I-
(1)需要进行滴定的反应是________________,终点的颜色变化为__________________。
(2)水中溶解O2为(以mg/L为单位)_____________________。
(3)加MnSO4及含NaOH的KI溶液振荡时,塞子若未塞紧(设未溅出溶液),测得结果将___________(填“偏高”“偏低”或“无影响”),原因是_____________________。
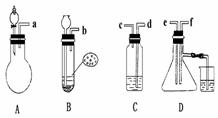 已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据 下图中A-D的实验装置和试剂进行实验,回答下列问题:
已知实验室制取H2S气体的原理是:FeS+H2SO? FeSO4+H2S.根据 下图中A-D的实验装置和试剂进行实验,回答下列问题: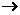 f各导管口连接起来,正确的顺序是 ,连 , 连 ;②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
f各导管口连接起来,正确的顺序是 ,连 , 连 ;②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
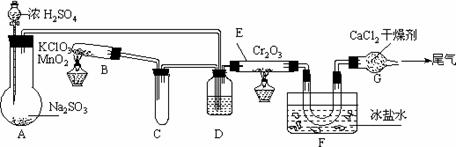
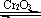 2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。