摘要:可逆反应.在反应过程中C的百分含量C%与温度的关 系如右图. 反应. (2)温度t<500℃时.C%逐渐增大的原因 . (3)温度t>500℃时.C%逐渐减少的原因是 .
网址:http://m.1010jiajiao.com/timu3_id_336145[举报]
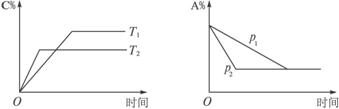
可逆反应aA(s)+bB(g)?cC(g)+dD(g);△H═Q KJ/mol.当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如图所示,以下判断正确的是( )
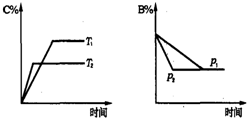

| A、T1<T2,Q>0 | B、Pl<P2,b═c+d | C、Tl>T2,Q<0 | D、P1<P2,a+b═c+d |
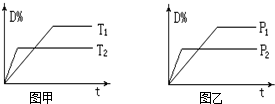 可逆反应mA(气)+nB(固)?rC(气)+qD(气)在反应过程中,其他条件不变,D的百分含量和T或P关系如图所示,下列叙述中正确的是( )
可逆反应mA(气)+nB(固)?rC(气)+qD(气)在反应过程中,其他条件不变,D的百分含量和T或P关系如图所示,下列叙述中正确的是( )| A、温度降低,化学平衡向正反应方向移动 | B、使用催化剂,D的物质的量分数增加 | C、物质B的颗粒越小,反应越快,有利于平衡向正反应方向移动 | D、化学方程式系数m<r+q |
可逆反应aA(s)+bB(g) cC(g) +dD(g) ΔH=Q kJ·mol-1。当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如下图所示,以下判断正确的是
cC(g) +dD(g) ΔH=Q kJ·mol-1。当其他条件不变时,反应过程中某物质在混合物中的百分含量与温度(T)、压强(p)的关系如下图所示,以下判断正确的是

A.T1<T2,Q>0 B.P1<P2,b=c+d
C.T1>T2,Q<0 D.P1<P2,a+b=c+d
查看习题详情和答案>>