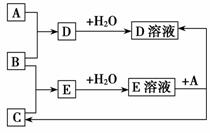
5. (2011年巢湖模拟)如图表示一些物质间的从属关系,不正确的是 ( )
(2011年巢湖模拟)如图表示一些物质间的从属关系,不正确的是 ( )
|
|
X |
Y |
Z |
H |
|
A |
分散系 |
胶体 |
溶液 |
烟 |
|
B |
电解质 |
酸 |
碱 |
盐 |
|
C |
元素周期表的纵列 |
主族 |
副族 |
卤族 |
|
D |
化合物 |
共价化合物 |
离子化合物 |
酸 |
解析:虽然酸、碱、盐都属于电解质,但盐不从属于酸,故B选项的有关物质间不符合图示的从属关系。
答案:B
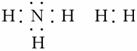 (3)
(3)  NH+OH-
NH+OH-