(一)必考题(11题,共129分)
26.(14分)
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,G的焰色反应为黄色。在一定条件下,各物质相互转化关系如下图:
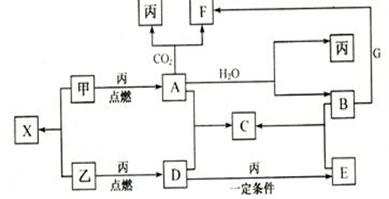
(1)写出C的化学式_____________;G的俗称_________;A的电子式_______
(2)写出A与H2O反应的离子方程式:____________________________________。
(3)写出F溶液通入CO2的离子方程式:__________________________________。
(4)写出D→E的化学方程式:___________________________________________。
(5)写出B与G生成F反应的离子方程式:_______________________________
|
Na2SO3(s)+ H2SO4(85%)== Na2SO4 + H2O + SO2↑
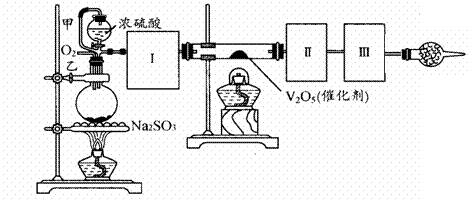
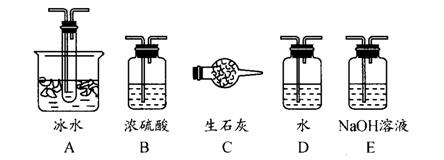
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A-E装置中选择最适合装置并将其序号填入下面的空格中。
Ⅰ、Ⅱ、Ⅲ处连接的装置分别是 _____ 、 _____ 、
_______ 。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 。若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不变”或“降低”)
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因并说明相应的验证方法(可以不填满)。
①原因 ,验证方法
②原因 ,验证方法
③原因 ,验证方法
(4)将SO2通入含1.5mol氯酸的溶液中,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式
(5)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为 %(用含a、b的代数式填写)
28.(15分)二甲醚(CH3OCH3)被称为21世纪的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能。工业制备二甲醚在催化反应室中(压力2.0-10.0Mpa,温度230-280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)
+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)
+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)若要增大反应①中H2的转化率,在其它条件不变的情况下可以采取的措施为 。
A.加入某物质作催化剂 B.加入一定量CO
C.反应温度降低 D.增大容器体积
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%,则5 min内CO的平均反应速率为 ;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2 mol/L,a= mol/L。
(3)催化反应室中总反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H=
;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
CH3OCH3(g)+CO2(g)的△H=
;830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(4)二甲醚的燃烧热为1455 kJ·mol-1,则二甲醚燃烧的热化学方程式为 。
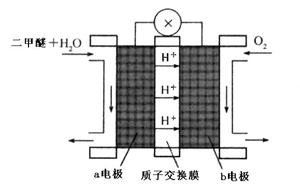
(5)“二甲醚燃料电池”是一种绿色电源,其工作原理如图所示。b电极是 极,写出a电极上发生的电极反应式 。
13.下列实验操作不能达到其对应目的的是 ( )
|
编号 |
实验操作 |
目的 |
|
A |
取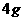  加入96mL水中 加入96mL水中(水的密度近似看作1g/ 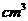 ) ) |
配置4% 溶液 溶液 |
|
B |
滴定实验中,用待测液润洗锥形瓶 |
避免造成误差使滴定结果偏低 |
|
C |
向 溶液中滴入酚酞溶液,加热 溶液中滴入酚酞溶液,加热 |
证明升高温度能促进 水解 水解 |
|
D |
向盛有铜片的试管中加入浓硫酸,加热 |
证明浓硫酸具有强氧化性 |
32.(16分)
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。干法、湿法制备高铁酸盐的原理如下表所示。
|
干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
|
湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
|
(1) 干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH=====2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
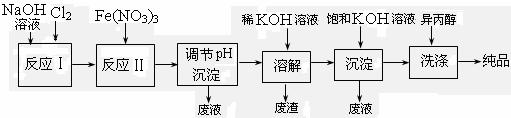
(2) 工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
①反应I的离子方程式为 。
②反应II的化学方程式为 。
③加入饱和KOH溶液的目的是 。
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。它能消毒杀菌是因为 ,它能净水的原因是
 ____ 。
____ 。
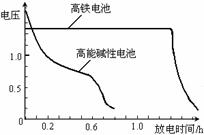
(4)高铁电池是正在研制中的可充电干电池,右图为高铁电池和常用的高能碱性电池的放电曲线,由图可得出高铁电池的优点有:工作电压稳定,
。
 C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2
mol·L-1。
C(g)+2D(g),经5 min后,测得容器内B的浓度减少了0.2
mol·L-1。 ( )
( )  (1)利用右下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,反应的离子方程式是______
_。
(1)利用右下图所示装置可间接证明二氧化碳与烧碱溶液发生了反应:将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是 ,反应的离子方程式是______
_。