18.(12分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的
金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备
钼酸钠晶体的部分流程如下:
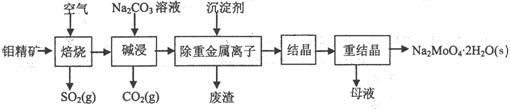
(1)写出“碱浸”反应的离子方程式: ▲
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是
▲ 。[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,
Ksp(BaSO4)= 1.1×10-10、Ksp(BaMoO4)= 4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
▲ 。
 (4)右图是碳钢在3种不同介质
(4)右图是碳钢在3种不同介质
中的腐蚀速率实验结果:
|
蚀速率随酸的浓度变化有
明显差异,其原因可能是
▲ 。
②空气中钼酸盐对碳钢的
缓蚀原理是在钢铁表面形
成FeMoO4-Fe2O3保护膜。
密闭式循环冷却水系统中
的碳钢管道缓蚀,除需加入
钼酸盐外还需加入NaNO2。NaNO2的作用是 ▲
③若缓释剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量
浓度为 ▲ 。
17.(10分)随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。 目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)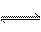 N2 (g)+CO2
(g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2
(g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
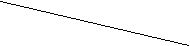 浓度/mol·L-1 浓度/mol·L-1
|
NO |
N2 |
CO2 |
||
|
0 |
0. 100 |
0 |
0 |
||
|
10 |
0.058 |
0. 021 |
0. 021 |
||
|
20 |
0. 040 |
0.030 |
0.030 |
||
|
30 |
0.040 |
0.030 |
0.030 |
||
|
40 |
0.032 |
0. 034 |
0.017 |
||
|
50 |
0. 032 |
0. 034 |
0. 017 |
①T1℃时,该反应的平衡常数K= ▲ (保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 ▲ 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H ▲ 0(填“>”、“=”或“<”)。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) + 2H2O(g) △H= -574 kJ·mol-1
②CH4(g)+4NO(g) =2N2(g) + CO2(g) + 2H2O(g) △H= -1160 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
 写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 ▲
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 ▲
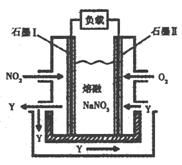
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在
使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应
可表示为 ▲

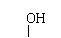
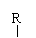
 ②羟基直接与碳碳双键相连不稳定:R-CH=CH-OH→R-CH2-CHO
②羟基直接与碳碳双键相连不稳定:R-CH=CH-OH→R-CH2-CHO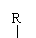 ③R-CH2-CH=O + R-CH-CHO
③R-CH2-CH=O + R-CH-CHO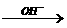 R-CH2-CH-CH-CHO
R-CH2-CH-CH-CHO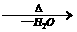
 c.不能发生银镜反应,但水解产物能发生银镜反应。
c.不能发生银镜反应,但水解产物能发生银镜反应。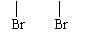 CH3CH2OH
CH3CH2OH CH2=CH2
CH2=CH2 CH2 - CH2
CH2 - CH2
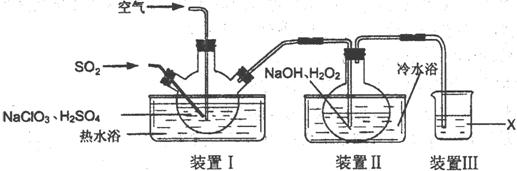
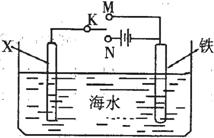 右图是模拟电化学反应装置图。下列说法正确的是
右图是模拟电化学反应装置图。下列说法正确的是