11.在容积不变的密闭容器中进行反应:2SO2 ( g
)+O2( g)  2SO3(g ) ;△H < O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g ) ;△H < O。下列各图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
|
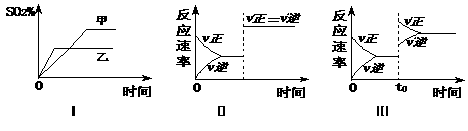
A .图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B .图Ⅱ表示t0时刻通人氦气对反应速率的影响
C .图Ⅱ表示t0时刻使用催化剂对反应速率的影响
D .图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
9.如图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则
|
|
R |
|
|
X |
Y |
Z |
下列说法正确的是
A.Y的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X
C.Y、R形成化合物的化合物YR2能使KMnO4溶液褪色
D.X、Z可形成化合物XZ3,且该化合物属离子化合物
4.现有Fe、Cu组成的合金,其Fe、Cu的总物质的量为amol,Cu的物质的量分数为x;研成粉末后,全部投入到含bmolHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
(1)用微粒符号填写下列空白(列举出全部可能的情况)
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
残留固体的成分 |
|
|
|
|
|
|
|
溶液澡的金属离子 |
|
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、b表示)___________。
(3)当x=0.5,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况下共产生672mL气体,求a、b的值。
答案:(1)
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
残留固体的成份 |
Fe、Cu |
Cu |
Gu |
-- |
-- |
-- |
|
溶液中的金属离子 |
Fe2+ |
Fe2+ |
Fe2+ 、Cu2+ |
Fe2+ 、Cu2+ |
Fe2+ 、Fe3+、Cu2+ |
Cu2+、Fe3+ |
(2)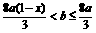
(3)a=0.04mol b=0.12mol
2.工业上用氧化铜制备CuCl2时,先将粗制的氧化铜粉(含有杂质FeO)用浓盐酸溶解,得到的氯化铜溶液中含有一定量的Fe2+。
附:一些金属氢氧化物沉淀的pH
|
金属离子 |
Ph |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
4.4 |
6.4 |
(1)从上表的数据可以看出,___________(填“能”与“不能”)用将溶液pH调到9.6的方法除去Fe2+,其原因是______________________。
(2)实际生产中先加入NaClO,目的是___________;
(3)为了除去杂质,宜调节溶液pH的范围为___________;调节pH宜选用的试剂是___________(选择填空)。
A.Ba(OH)2 B.MgCO3 C.CuO D.CuCl2
答案:(1)不能;pH为9.6时,Cu2+与Fe2+一起以氢氧化物的形式完全沉淀,达不到除杂质的目的
(2)将Fe2+氧化为Fe3+,并适当调高溶液的pH
(3)3.7-4.4;C
 银锌(Ag-Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应为:Ag2O + Zn
+ H2O 2Ag
+ Zn(OH)2 ,则下列说法正确的是
银锌(Ag-Zn)可充电电池广泛用做各种电子仪器的电源,电解质为KOH。其电池总反应为:Ag2O + Zn
+ H2O 2Ag
+ Zn(OH)2 ,则下列说法正确的是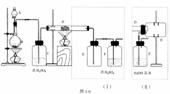 试回答:
试回答: MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑