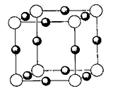
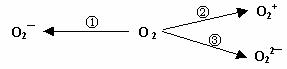0 32336 32344 32350 32354 32360 32362 32366 32372 32374 32380 32386 32390 32392 32396 32402 32404 32410 32414 32416 32420 32422 32426 32428 32430 32431 32432 32434 32435 32436 32438 32440 32444 32446 32450 32452 32456 32462 32464 32470 32474 32476 32480 32486 32492 32494 32500 32504 32506 32512 32516 32522 32530 447348
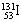 ,但这些极微量的放射性物质对我国环境和公众健康不会产生影响。该同位素原子的中子数和质子数之差是
,但这些极微量的放射性物质对我国环境和公众健康不会产生影响。该同位素原子的中子数和质子数之差是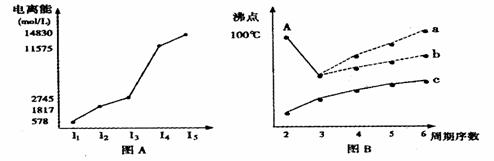
 ③ 钛合金,密度小、比强度高、耐腐蚀性强,用于涡轮发动机和飞机构架,其缺点是在一定条件下会燃烧,目前阻燃钛合金是工程实用化的主攻方向。钛合金在物质分类中属于____________________(填“混合物”或“化合物”)。
③ 钛合金,密度小、比强度高、耐腐蚀性强,用于涡轮发动机和飞机构架,其缺点是在一定条件下会燃烧,目前阻燃钛合金是工程实用化的主攻方向。钛合金在物质分类中属于____________________(填“混合物”或“化合物”)。