20.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
⑴不考虑其它组的实验结果,只从甲组情况分析,
若a 7(填>、<或=),则HA为强酸;若a 7(填>、<或=),则HA为弱酸。
⑵在乙组中混合溶液中离子浓度(A-)与(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
⑶从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是 。
⑷丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
19.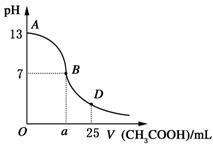 I.右图为向25mL 0.1 mol·L-1
NaOH溶液中逐滴滴加0.2
mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
I.右图为向25mL 0.1 mol·L-1
NaOH溶液中逐滴滴加0.2
mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
⑴B点溶液呈中性,此时a 12.5
(填“>”、“<”或“=”)。有人据此认为,在
B点时NaOH与CH3COOH恰好完全中和,这种
看法是否正确? (选填“是”或“否”)。
若不正确,则二者恰好完全中和的点是在AB区间还是BD区间内? 区间(若正确,此问不答)。
⑵关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)
|
滴定终点时的现象为:
⑶AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
⑷在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。(填“>”、“<”或“=”)
II.酸碱中和滴定实验是中学阶段重要的定量实验之一。根据所学内容,试回答下列问题:
⑸滴定管精确度较高,可读至 mL。准确量取KMnO4溶液可用 式滴定管。
⑹滴定时其余操作均准确,若用待测液润洗锥形瓶,则测得待测液的浓度 (填偏高、偏低、不变。下同);若盛放标准液的滴定管下端有气泡,且在滴定过程中排出,则测得待测液的浓度
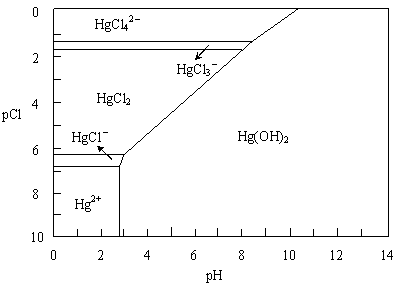 [注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]。
[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]。