22.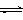 (21分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) △H﹥0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
(21分)一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g) △H﹥0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
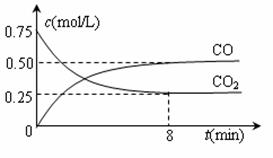
⑴该反应的平衡常数表达式K= 。
⑵下列措施中能使平衡时K增大的是 填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.降低温度
⑶8分钟内,CO的平均反应速率V(CO)= mol/(L·min)。
⑷1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
|
容器 |
甲 |
乙 |
|
反应物投入量 |
3mol Fe、2mol CO2 |
4mol FeO、3mol CO |
CO的浓度(mol·L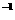 ) ) |
C1 |
C 2 |
|
CO2的的体积分数 |
φ1 |
φ2 |
|
体系压强(Pa) |
p1 |
p2 |
|
气态反应物的转化率 |
α1 |
α2 |
①下列说法正确的是 。
A.2C1 =3C 2 B.φ1 =φ2 C.p1 <p2 D.α1=α2
②求C1、φ1、α2
过程:
 江苏省盐城中学2010-2011学年度第二学期期中考试
江苏省盐城中学2010-2011学年度第二学期期中考试
21.(14分)用中和滴定法测定某烧碱的纯度
(1)配制待测液:将2.0g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要的玻璃仪器有 (任填两种)。
(2)滴定:
①盛装0.20mol·L-1盐酸标准液应该用 式滴定管。
②滴定时,应先向锥形瓶中加1-2滴 作为指示剂。
③有关数据的记录如下:
|
滴定序号 |
待测液体体积(mL) |
所耗盐酸标准液的体积(mL) |
|
|
滴定前 |
滴定后 |
||
|
1 |
20.00 |
0.50 |
20.70 |
|
2 |
20.00 |
6.00 |
25.80 |
|
3 |
20.00 |
1.20 |
21.20 |
|
4 |
20.00 |
2.00 |
34.00 |
(3)纯度计算:烧碱样品的纯度为 。
(4)对几种假定情况的讨论:(填“偏大”“不变”或“偏小”)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果 。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外则会使测定结果 。
③滴定终了仰视读数,则会是测定结果 。
 (9分)反应m A+n B pC在某温度下达到平衡。
(9分)反应m A+n B pC在某温度下达到平衡。
 对于可逆反应,A2(g)+3B2(g) 2AB3(g) △H<0下列图像正确的是
对于可逆反应,A2(g)+3B2(g) 2AB3(g) △H<0下列图像正确的是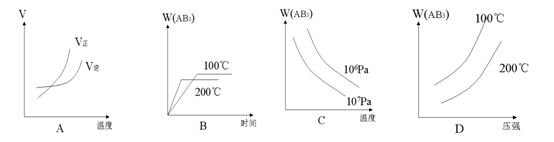

 A.该溶液中存在硝酸分子
A.该溶液中存在硝酸分子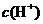 与水电离出的
与水电离出的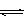 H++OH- ΔH>0,下列叙述正确的是
H++OH- ΔH>0,下列叙述正确的是