14、(10分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
 (1)该实验应选用
作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是
。
(1)该实验应选用
作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是
。
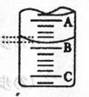
(2)右图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,
A处的刻度为25,滴定管中液面读数应为 mL。,此时滴定管中液体的体积 .
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL, NaOH标准漓浓度为c mol·L-1,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.32 |
25.28 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度表达式(不必化简): 。
(本题共两小题,20分)
 (3) 镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为
,NiO(OH)溶于浓盐酸的化学方程式为
。
(3) 镍常见化合价为+2、+3, 在水溶液中通常只以+2 价离子的形式存在。+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应。Ni3+的电子排布式为
,NiO(OH)溶于浓盐酸的化学方程式为
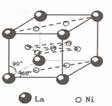
。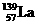 )组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=
。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为:
)组成的一种合金LaNix是较好的储氢材料,能快速可逆地存储和释放H2。LaNix的晶胞如图,其储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成LaNixH6。LaNixH6中,x=
。该贮氢的镧镍合金、泡沫氧化镍、氢氧化钾溶液组成的镍氢电池被用于制作原子钟,反应原理为: 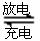 LaNix+y
NiO+y H2O。写出其放电时负极的电极反应方程式 [来
LaNix+y
NiO+y H2O。写出其放电时负极的电极反应方程式 [来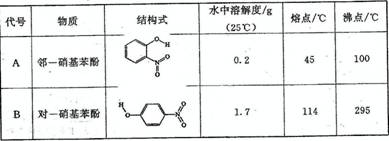 (2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。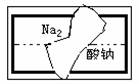 (2)(6分)、某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验加以验证。
(2)(6分)、某同学在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验加以验证。