0 30845 30853 30859 30863 30869 30871 30875 30881 30883 30889 30895 30899 30901 30905 30911 30913 30919 30923 30925 30929 30931 30935 30937 30939 30940 30941 30943 30944 30945 30947 30949 30953 30955 30959 30961 30965 30971 30973 30979 30983 30985 30989 30995 31001 31003 31009 31013 31015 31021 31025 31031 31039 447348
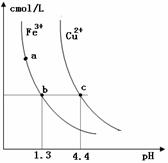 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的改变如图所示。据图分析,下列判断错误的是
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的改变如图所示。据图分析,下列判断错误的是 OH)3]< Ksp[Cu(OH)2]
OH)3]< Ksp[Cu(OH)2] 点变到
点变到 点
点 、d两点代表的溶液中c(H+)与c(OH-)乘积相等
、d两点代表的溶液中c(H+)与c(OH-)乘积相等 (OH)2所在溶液分别达到饱和
(OH)2所在溶液分别达到饱和
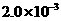 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示: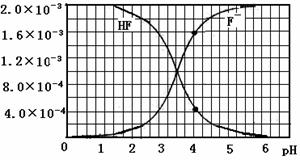
 。
。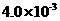 mol·L-1HF溶液与
mol·L-1HF溶液与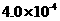 mol·L-1 CaCl2溶液等体
mol·L-1 CaCl2溶液等体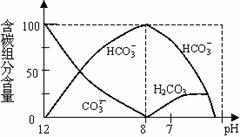 (2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的 各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如右图所示。
各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如右图所示。
 溶液中:K+、OH-、SiO32-、SCN-
溶液中:K+、OH-、SiO32-、SCN-