7.完成下列表格
|
溶液 |
溶质 |
溶剂 |
溶液 |
溶质 |
溶剂 |
|
蔗糖水 |
|
|
铁与稀硫酸恰好反应后所得溶液 |
|
|
|
稀硫酸 |
|
|
二氧化硫溶于水所得溶液 |
|
|
|
碘酒 |
|
|
95%酒精 |
|
|
|
澄清石灰水 |
|
|
含3%的植物油的酒精溶液 |
|
|

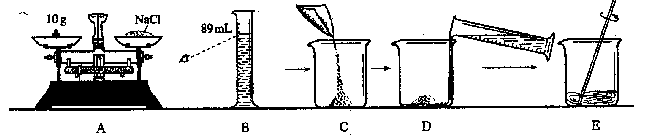 为监测某厂污水中有毒金属离子含量,需配制100g11%的氯化钠溶液。某学生按如图所示步骤顺序操作。
为监测某厂污水中有毒金属离子含量,需配制100g11%的氯化钠溶液。某学生按如图所示步骤顺序操作。 (2)操作错误应纠正为
。
(2)操作错误应纠正为
。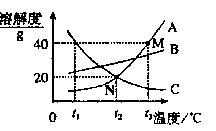 如图为A、B、C三种固体物质的溶解度曲线图。
如图为A、B、C三种固体物质的溶解度曲线图。