23.(8分)化学兴趣小组通过分析工业合成氨的化学反应:N2(g)+3H2(g) 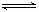 2NH3(g),现在四种实验条件下NH3的浓度(mol/L)随反应时间(min)变化的实验数据如下表,实验条件是:压强恒定(4.31×1010 Pa),N2、H2起始浓度均为0,而温度、浓度等其他条件有所不同。
2NH3(g),现在四种实验条件下NH3的浓度(mol/L)随反应时间(min)变化的实验数据如下表,实验条件是:压强恒定(4.31×1010 Pa),N2、H2起始浓度均为0,而温度、浓度等其他条件有所不同。
|
实验序号 |
 时间(min) 时间(min)
|
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
t7 |
||
|
1 |
500℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
||
|
2 |
500℃ |
1.0 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
||
|
3 |
500℃ |
c |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
||
|
4 |
T |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)可推测实验室2中还隐含的条件是 。
(2)设实验3的反应速率为y3,实验1的反应速率为y1,则y3 y1(填<、=、>),且c
1.0 mol/L(填<、=、>)。
(3)比较实验4和实验1,可推测温度T 500℃(填<、=、>)
(4)从影响反应速率和平衡的因素分析,要有利于NH3的生成,在实际合成氨的过程中,要不断分离出NH3,目的是 。
22.(6分)为了研究浓度、温度对化学反应速率的影响,利用Na2S2O3(3%)在酸性条件下产生不溶于水的S,形成乳白色浑浊的反应,测量所需时间来证明不同浓度或不同温度下化学反应速率的不同。
(1)写出该反应的离子方程式 。
(2)取3个小烧杯,编号为1、2、3,在烧杯底部中央画上粗细相同的“+”号,按下表分别进行处理,记下从澄清到看不到“+”号所需的时间。
|
编号 |
加Na2S2O3 的体积(mL) |
加水的体积(mL) |
加H2SO4 的体积(mL) |
所需时间(秒) |
|
1 |
5 |
5 |
2 |
a |
|
2 |
7 |
3 |
2 |
b |
|
3 |
10 |
0 |
2 |
c |
① 加水的作用是 。
② a、b、c三者的关系为 。
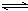 对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请计算:(1)
x的值是多少?(2) L的转化率是多少?(3) M的反应速率v(M)是是多少?(必须用三段式书写)
对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,请计算:(1)
x的值是多少?(2) L的转化率是多少?(3) M的反应速率v(M)是是多少?(必须用三段式书写) 温度
温度 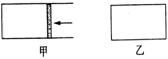 (10分)一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol/L。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。
(10分)一定温度下,分别往容积均为5 L的甲(恒压密闭容器)、乙(恒容密闭容器)中各加入0.5 mol无色的N2O4气体,立即出现红棕色。当反应进行到2 s时,测得乙容器中N2O4的浓度为0.09 mol/L。经过60 s乙容器中的反应达到平衡(反应过程中两个容器的温度均保持恒定)。 (6分)某温度下,在某固定体积的密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),SO2和O2的起始浓度分别为3mol/L和2 mol/L,达平衡时,80%的SO2转化为SO3,这时c(SO2)=
,c(O2)=
,c(SO3)=
。容器内压强等于反应前压强的 %。如果温度不变,向上述平衡体系中通入氩气,容器内压强将
(从“增大”、“减小”、“不变”中选填),平衡 移动(从“正向”、“逆向”、“不”中选填)。
(6分)某温度下,在某固定体积的密闭容器中进行下列反应:2SO2(g)+O2(g) 2SO3(g),SO2和O2的起始浓度分别为3mol/L和2 mol/L,达平衡时,80%的SO2转化为SO3,这时c(SO2)=
,c(O2)=
,c(SO3)=
。容器内压强等于反应前压强的 %。如果温度不变,向上述平衡体系中通入氩气,容器内压强将
(从“增大”、“减小”、“不变”中选填),平衡 移动(从“正向”、“逆向”、“不”中选填)。