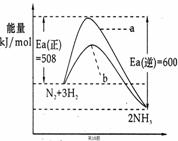
18.根据碰撞理论,分子在发生反应时必须要进行有效碰撞。那些具有足够高能量,能发生有效碰撞的分子称为活化分子,要使普通分子成为活化分子所需最小能量称为活化能(Ea)。一定温度下气体分子中的活化分子百分数是一定的,而催化剂可以改变活化能的大小。如下图表示298.15K时,N2、H2与NH3的平均能量与合成氨反应的活化能的曲线图,据图回答:
(1)若反应中生成2mol氨.则反应 (填“吸热”或“放热”) kJ
(2)在图中曲线 (填“a”或“b”)表示加入铁触媒的能量变化曲线,铁触媒能加快反应速率的原理是 ;
 (3)目前合成氨工业广泛采用的反应条件500℃、20~50MPa、
(3)目前合成氨工业广泛采用的反应条件500℃、20~50MPa、
铁触媒,反应转化率不超过50%,工业上为了进一步
提高氨气产率,你认为下列措施最经济可行的是 ;
A.降低反应温度,让反应向着有利氨气生成的方向进行
B.升高温度,让更多的分子变成活化分子
C.寻求能在更低的温度下有很强催化活性的新型催化剂
D.寻求新型耐高压材料,将压强增大一倍
(4)在一定条件下,将3molN2和3molH2充入一个容积固定的密闭容器中发生反应.当反应达到平衡时NH3为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时NH3仍为n mol,则下列组合中正确的是 (填编号)。
|
编号 |
起始状态/mol |
||
|
N2 |
H2 |
NH3 |
|
|
① |
2 |
0 |
2 |
|
② |
2.5 |
1.5 |
1 |
|
③ |
8/3 |
2 |
2/3 |
|
④ |
0 |
0 |
2 |
 放
放 出942KJ能量,根据以上信息和数据判断下列说法正确的是 ( )
出942KJ能量,根据以上信息和数据判断下列说法正确的是 ( ) O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol
O2(g)=CO2(g)+2H2O(l) ΔH=+725.8KJ/mol 6CO2+6H2O
6CO2+6H2O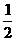 O2 (g)=CO2 (g) ΔH=-283.0kJ·mol-1
O2 (g)=CO2 (g) ΔH=-283.0kJ·mol-1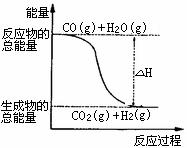 ②H2(g)
+
②H2(g)
+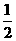 O2 (g) =H2O(g);ΔH=-241.8
kJ·mol-1则下列说法正确的是 (
)
O2 (g) =H2O(g);ΔH=-241.8
kJ·mol-1则下列说法正确的是 (
) 
 在如图所示的三个容积相同的容器①、②、
在如图所示的三个容积相同的容器①、②、 2C(g) △H<0.
2C(g) △H<0. (2)若维持温度不变,起始时②中投入3molA、1molB;③中投入3
molA、1molB和2molC,则达到平衡时,两容器中B的百分含量②_____________③(填<、>或=)
(2)若维持温度不变,起始时②中投入3molA、1molB;③中投入3
molA、1molB和2molC,则达到平衡时,两容器中B的百分含量②_____________③(填<、>或=)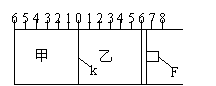 甲中充入2molA和1molB,乙中充入2molC和
甲中充入2molA和1molB,乙中充入2molC和