0 23542 23550 23556 23560 23566 23568 23572 23578 23580 23586 23592 23596 23598 23602 23608 23610 23616 23620 23622 23626 23628 23632 23634 23636 23637 23638 23640 23641 23642 23644 23646 23650 23652 23656 23658 23662 23668 23670 23676 23680 23682 23686 23692 23698 23700 23706 23710 23712 23718 23722 23728 23736 447348
 2C(g)+D(g)在四种不同条件下的反应速率分别为
2C(g)+D(g)在四种不同条件下的反应速率分别为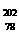 Pt的说法正确的是
Pt的说法正确的是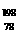 Pt是同一种核素
B.
Pt是同一种核素
B.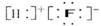
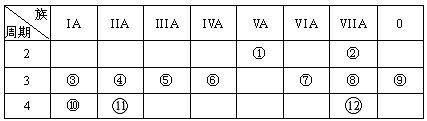
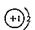 下列化学用语的表示中,正确的是
下列化学用语的表示中,正确的是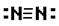
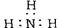
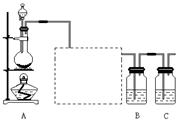 (11分,每空1分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(11分,每空1分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
 (1)该反应的化学方程式为
。
(1)该反应的化学方程式为
。