|
晶体类型 |
离子晶体 |
原子晶体 |
分子晶体 |
|
|
结构 |
构成晶体的微粒 |
阴离子和阳离子 |
原子 |
分子 |
|
相互的作用力 |
离子键 |
共价键 |
范德华力 |
|
|
可能存在的作用力 |
一定有离子键,可能有共价键(离子内) |
只有共价键 |
一定存在范德华力,分子内可能存在共价键 |
|
|
性质 |
熔 沸 点 |
较高 |
很高 |
较低 |
|
硬 度 |
较大 |
很大 |
较小 |
|
|
导 电 性 |
固态不导电,熔化状态或溶于水导电。 |
一般不导电 |
固态或熔化状态下均不导电,某些水溶液导电 |
|
|
溶 解 性 |
一般易溶于水,难溶于有机溶剂。 |
一般难溶于任何溶剂 |
相似相溶原理 |
|
|
存 在 实
例 |
金属氧化物、 强碱、盐 |
金刚石、晶体硅、二氧化硅、碳化硅。 |
非金属单质(除C、Si)非金属氧化物、气态氢化物、酸等。 |
(三)元素的相对原子质量的计算
公式: 。

8、随堂练习:1、有以下一些微粒:①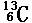 ②
②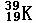 ③
③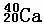 ④
④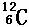 ⑤
⑤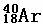
其中互为同位素的是 和
质量数相等但不能互为同位素的是 和
中子数相等,但质子数不等的是 和 、 和 。
2、下列各组中属于同位素的是( )
A、40K与40Ca B、T2O和H2O C、40K与39K D、金刚石与石墨
9、反思:(通过本课学习、作业后你有哪些没有搞懂的知识,请记录下来)
6、课后练习:
1、钛(Ti)金属常被称为未来钢铁。钛元素的同位素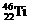 、
、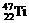 、
、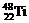 、
、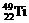 、
、 中,中子数不可能为 ( )
中,中子数不可能为 ( )
A、28 B、30 C、26 D、24
2、据报道,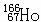 可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( )
A.32 B.67 C.99 D.166
3、在 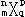 中,m、n、p、q表示X的四个角码,若X1和X2的q均为1,m、p的值相等,则X1和X2表示的可能是
( )
中,m、n、p、q表示X的四个角码,若X1和X2的q均为1,m、p的值相等,则X1和X2表示的可能是
( )
A、不同种元素的原子 B、同种元素的不同种原子
C、同种元素不同种原子形成的离子 D、不同元素的离子
4、某元素原子核内质子数为m,中子数为n,则下列论断正确的是 ( )
A、不能由此确定该元素的相对原子质量
B、这种元素的相对原子质量为m+n
C、若12C原子质量为Wg,则此元素原子的质量为(m+n)Wg
D、该元素原子核内中子的总质量小于质子的总质量
5、道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的粒子;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子--分子学说的观点看,你认为不正确的是 ( )
A.只有① B.只有② C.只有③ D.①②③
6、据报道,月球上有大量3He存在,以下关于3He的说法正确的是 ( )
A、是4He的同素异形体 B、比4He多一个中子
C、是4He的同位素 D、比4He少一个质子
7、1 mol D2O和1 mol H2O不相同的是 ( )
A.含氧原子的数目 B.质量 C.含有质子的数目 D.含有中子的数目
8、n mol H2与n mol T2气体不同之处是 ( )
A.物质的量 B.原子数 C.质量 D.体积(相同状况)
9、Se是人体必需微量元素,下列关于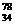 Se和
Se和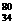 Se说法正确的是
( )
Se说法正确的是
( )
A.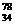 Se和
Se和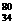 Se互为同素异形体
B.
Se互为同素异形体
B.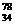 Se和
Se和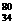 Se互为同位素
Se互为同位素
C.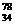 Se和
Se和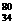 Se分别含有44和46个质子 D.
Se分别含有44和46个质子 D.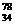 Se和
Se和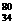 Se都含有34个中子
Se都含有34个中子
10、已知自然界氧的核素有16O、17O、18O,氢的核素有 H、D,从水分子的原子组成来看,自然界的水一共有 ( )
A、3种 B、6种 C、9种 D、12种
11、阴离子Xn-含中子N个,X的质量数为A,则a g X的氢化物中含质子的物质的量是
( )
A.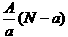 mol
B.
mol
B.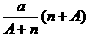 mol
mol
C.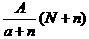 mol
D.
mol
D.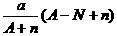 mol
mol
12、由1H、2H、3H、35Cl、37Cl组成的氯化氢分子中,用精密的仪器检测这些分子,可测出____________种氯化氢分子,氯化氢分子的相对分子质量有________种。
13、填表:
|
|
质子数 |
中子数 |
电子数 |
|
2713Al |
|
|
|
|
168O2- |
|
|
|
|
|
19 |
20 |
18 |
|
|
17 |
20 |
18 |
14、认真计算并填空:
① 相同物质的量的重水(D2O)与普通水(H2O)的质量之比为________________;
② 相同质量的14C18O与SO2的分子数之比为____________;原子数之比为____________;中子数之比为____________;质子数之比为____________;
15、硼元素的相对原子质量为10.8,则10B与11B的原子个数比为

定义 。
符号: 计算式:质量数(A) === 。
应用:用质量数表示某种原子
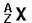
 它表示的含义是什么?
它表示的含义是什么?
。
3、科学探究:1、填写下表,总结A与相对原子质量的关系。
|
原子 |
质子数 (Z) |
中子数 (N) |
质子数+中子数 (A) |
相对原子质量 |
|
F |
|
10 |
|
18.998 |
|
Na |
|
12 |
|
22.990 |
|
Al |
|
14 |
|
26.982 |
2、原子形成离子之后构成原子的微粒哪些发生了变化?如何改变?质量数呢?
4、总结和比较: 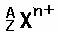 和
和 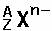 中的质子数、中子数、质量数和电子数。
中的质子数、中子数、质量数和电子数。

5、随堂练习:1、完成表格1
|
符号 |
质子数 |
中子数 |
质量数 |
电子数 |
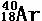 |
|
|
|
|
 |
|
|
|
|
|
|
12 |
12 |
|
12 |
|
|
|
20 |
40 |
18 |
2、完成表2
|
元素符号 |
原子符号 |
核电荷数 |
中子数 |
电子数 |
|
|
|
1 |
0 |
1 |
|
|
1 |
1 |
1 |
|
|
|
1 |
2 |
1 |
|
|
|
|
6 |
6 |
6 |
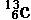 |
|
|
|
|
|
|
6 |
8 |
6 |
6、自主学习:(二)核素和同位素
核素:
同位素:
7、思考与交流:1、元素、核素、同位素的不同和联系。在周期表中收入了112种元素,是不是就只有112种原子呢?
2、Cl元素有两种天然同位素 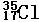 、
、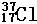 。
。
⑴在形成的Cl2分子中,会有 种不同的分子,它的相对分子质量分别为
、 。
⑵从原子的组成看,原子的质量数均为整数,但氯元素的相对原子质量却是35.5,这是为什么?
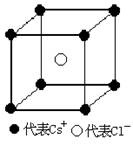 若氯化钠晶体的密度为
若氯化钠晶体的密度为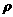 g/cm3,若氯化钠的摩尔质量为Mg/mol则求Na+与Cl-之间的距离为______cm,Cl-与Cl-之间的距离为_________cm。
g/cm3,若氯化钠的摩尔质量为Mg/mol则求Na+与Cl-之间的距离为______cm,Cl-与Cl-之间的距离为_________cm。