铁的化学性质:铁是较活泼的金属(或中等活泼金属)表现为还原性。
|
|
铁 |
|
||||||||||
|
(1)与非金属反应 |
①铁生锈(铁在潮湿空气中被腐蚀生成Fe2O3)
④3Fe+2O2 === Fe3O4(2价Fe占 |
Cu +O2 === 2CuO
|
||||||||||
|
(2)与酸反应 |
①非强氧性的酸:Fe + 2H+
== Fe2+ + H2↑ ②强氧性的酸(浓H2SO4、HNO3): a.常温下钝化(浓H2SO4、浓HNO3用铁制容器盛装) b.一定条件下反应生成Fe(Ⅲ) |
①非强氧性的酸: 不反应 ②强氧性的酸(浓H2SO4、HNO3):在一定条件下生成Cu(Ⅱ) |
||||||||||
|
(3)与盐溶液反应 |
(1) Fe + Cu2+ == Fe2+ + Cu (2) Fe + 2Fe3+ == 3Fe2+ |
Cu + 2Ag+=2Ag + Cu2+ Cu + 2Fe3+=2Fe2+ + Cu2+(实验现象:铜粉溶解,溶液颜色发生变化。) |
Fe2+与Fe3+的相互转化:
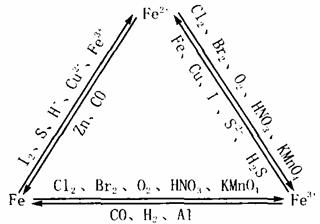
Fe3+的检验:(黄棕色)
实验①:向FeCl3 溶液中加入几滴KSCN溶液,溶液显血红色,
Fe3++3SCN- Fe(SCN)3
Fe(SCN)3
实验②:向FeCl3溶液加入NaOH溶液,有红褐色沉淀。
Fe3++2OH- Fe(OH)3↓
Fe(OH)3↓
Fe2+的检验:(浅绿色)
实验:向FeCl2溶液加入NaOH溶液。
Fe2++2OH- Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O
Fe(OH)2↓(白色/浅绿色)4Fe(OH)2+O2+2H2O 4Fe(OH)3(红褐色)
4Fe(OH)3(红褐色)
|
|
|
(3) 除SiO2:CaCO3===CaO+CO2↑,CaO+SiO2===CaSiO3
炼铜:1.高温冶炼黄铜矿→电解精制;2.湿法炼铜:Fe + CuSO4 = FeSO4 + Cu;3.生物炼铜
(1) 与酸的反应:2Al + 6HCl = 2AlCl3 + 3H2↑
(2) 与碱的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
第一步:2Al+6H2O= 2Al(OH)3+3H2↑
第二步:Al(OH)3+NaOH=NaAlO2+2H2O
★ 总方程式: 2Al+2NaOH+6H2O=2NaAlO2+ 4H2O +3H2↑
(3) 钝化:在常温下,铝与浓硝酸、浓硫酸时会在表面生成致密的氧化膜而发生钝化,不与浓硝酸、浓硫酸进一步发生反应。
(4)
|
2Al + Fe2O3 === 2Fe + Al2O3
铝热剂:铝粉和某些金属氧化物(Fe2O3、FeO、Fe3O4、V2O5、Cr2O3、MnO2)组成的混合物。
①溶解:Al2O3+2NaOH === 2NaAlO2+H2O
②过滤:除去杂质
③酸化:NaAlO2+CO2+2H2O === Al(OH)3↓+NaHCO3
|
⑤灼烧:2Al(OH)3 ======= 4Al+3O2↑
铝合金特点:1、密度小2、强度高3、塑性好4、制造工艺简单5、成本低6、抗腐蚀力强
 H2O + SiO2 ,
H2O + SiO2 ,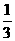 ,2价Fe占2/3)
,2价Fe占2/3)