网址:http://m.1010jiajiao.com/timu3_id_164276[举报]
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,无机非金属材料和金属材料在我们生活中有着极其广泛的用途.根据你学过的有关材料的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,无机非金属材料和金属材料在我们生活中有着极其广泛的用途.根据你学过的有关材料的知识,回答下列问题:(1)下列材料中的
①光导纤维②铝合金 ③钢铁 ④晶体硅 ⑤高温结构陶瓷
粗硅的制备是以石英和焦炭为原料在高温发生反应而制得,该反应的化学方程式为
(2)青铜是我国使用最早的合金,铜钱在我国历史上曾经是一种广泛流通的货币.下列有关铜合金的说法正确的是
A.我国较早的掌握了湿法冶炼钢的技术
B.铜的性质不活泼,自然界有大量的游离态的铜
C.常见的铜合金除了青铜外还有黄铜和白铜
D.铜常用于制造货币的原因是铜合金的熔点较低,易于冶炼、铸造成型,且不易被腐蚀
(3)“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种.某研究所将纳米碳均匀的分散到蒸馏水中,得到的分散系:①是溶液 ②是胶体 ③具有丁达尔现象 ④不能透过滤纸 ⑤不能透过半透膜 ⑥静止后会出现黑色沉淀.其中正确的是
(1)以铁为研究对象,仿照下图中的实例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质,生成物必须填写铁的化合物)。
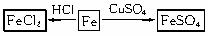
(2)实验室要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去。(只用简单的原理描述即可)
(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一。联系生活生产实际,举出防止钢铁生锈的两种常用方法:?
①________________。?
② ________________。?
(4)经研究发现,长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是________________________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是________________________。
查看习题详情和答案>>(1)以铁为研究对象,仿照下图中的案例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质,生成物必须填写铁的化合物)。

(2)实验室要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去。(只用简单的原理描述即可)
(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一。联系生活生产实际,举出防止钢铁生锈的两种常用方法:
①__________________________________________________________________。
②__________________________________________________________________。
(4)经研究发现,长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是______________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是_________________________________。
查看习题详情和答案>>铁是一种化学性质比较活泼的金属,也是用途最为广泛的金属。铁在一定条件下能跟多种物质发生化学反应。完成下列问题:?
(1)以铁为研究对象,仿照下图中的实例在框图处填写物质的化学式(所填写的反应物不属于同一类别的物质,生成物必须填写铁的化合物)。

(2)实验室要除去细碎铜屑中的少量铁屑,请用化学方法和物理方法将其除去。(只用简单的原理描述即可)
(3)据统计,每年锈蚀的钢铁约占世界钢铁年产总量的四分之一。联系生活生产实际,举出防止钢铁生锈的两种常用方法:?
①________________。?
② ________________。?
(4)经研究发现,长期使用铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,原因是________________________________;如果在炒菜时经常加入适量的食用醋,效果会更好,理由是________________________。
查看习题详情和答案>>(1)铜钱在我国历史上曾经是一种广泛流通的货币,铜常用于制造货币的原因可能是____(填序号)。
A.铜的熔点不是太高,易于冶炼,铸造成型
B.铜的性质不活泼,不易被腐蚀
C.我国较早地掌握了湿法冶炼铜的技术
D.自然界有大量的游离态的铜

(3)铝制品因为表面易形成致密的氧化铝薄膜而经久耐用,但是该氧化膜易被酸碱破坏,若使氧化铝与氢氧化钠溶液作用,反应的化学方程式为___。