|
|

 表示质量数为A、质子数为Z的具体的X原子。
表示质量数为A、质子数为Z的具体的X原子。
|

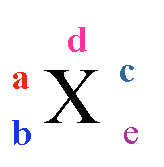

质量数(A)=质子数(Z)+中子数(N)
(1) 原子:核电荷数(质子数)=核外电子数,
(2) 阳离子:核电荷数(质子数)>核外电子数,
(3) 阴离子:核电荷数(质子数)<核外电子数,
核素:具有一定质子数和一定中子数的一种原子。
同位素:质子数相同、质量数(中子数)不同的原子(核素)互为同位素
专题二 从海水中获得的化学物质
第一单元 氯、溴、碘及其化合物
|
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
负极 正极
近代原子结构模型的演变
|
模型 |
道尔顿 |
汤姆生 |
卢瑟福 |
玻尔 |
量子力学 |
|
年代 |
1803 |
1904 |
1911 |
1913 |
1926 |
|
依据 |
元素化合时的质量比例关系 |
发现电子 |
ɑ粒子散射 |
氢原子光谱 |
近代科学实验 |
|
主要内容 |
原子是不可再分的实心小球 |
葡萄干面包式 |
含核模型 |
行星轨道式原子模型 |
量子力学 |
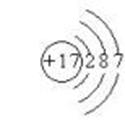
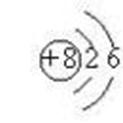
1. 核外电子排布规律:
(1) 核外电子总是尽先排布在能量较低的电子层,然后由里向外,排布在能量较高的电子层
(2) 原子核外各电子层最多容纳2n2个电子(表示电子层数)。
(3) 原子最外野电子数目不能超过8个(第一层不能超过2个)
(4) 次外层电子数目不能超过18个(第一层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。


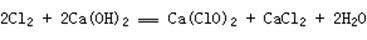
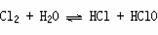
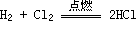
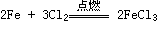 Cl2与金属反应(一般将金属氧化成高价态)
Cl2与金属反应(一般将金属氧化成高价态)