题目内容
4.某溶液中只可能含有下列离子中的几种:K+、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g则:
(1)该溶液中肯定含有的离子K+、NH4+ SO42-、NH4+
(2)该溶液中一定不含有的离子CO32-
(3)该溶液中是否含有K+,是(填“是”或“否);说明理由含有NH4+,且物质的量为0.01mol,含有SO42-,且物质的量为:n=$\frac{2.33g}{233g/mol}$=0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子;若存在其离子浓度范围≥0.1mol/L.
分析 第一份加入足量的烧碱并加热会产生在标准状况下为224mL气体证明含有NH4+,且物质的量为0.01mol;
第二份先加入足量的盐酸,无现象,则不含有CO32-,再加足量的BaCl2溶液,得固体2.33g,证明含有SO42-.,且物质的量为0.01mol,根据溶液呈电中性原理,判断是否含有NO3-,据此即可解答.
解答 解:第一份加入足量的烧碱并加热,因NH4++OH-═NH3↑+H2O,会产生标准状况下为224mL气体,证明含有NH4+,且物质的量为0.01mol;
第二份先加入足量的盐酸,无现象,则一定不含有CO32-,再加足量的BaCl2溶液,得固体2.33g,证明一定含有SO42-,且物质的量为:n=$\frac{2.33g}{233g/mol}$=0.01mol;
根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,且钾离子的浓度≥$\frac{0.01mol×2-0.01mol}{0.1L}$=0.1mol/L,所以该溶液中肯定含有NH4+、S042-、K+;
如果K+的物质的量等于0.01mol,则不含NO3-,如果K+的物质的量大于0.01mol,则还应含有NO3-;分析可知一定含有钾离子,肯定存在的离子有K+、NH4+ SO42-、NH4+,CO32-一定不存在,硝酸根离子可能存在,
(1)该溶液中肯定含有的离子是K+、NH4+ SO42-、NH4+,故答案为:K+、NH4+ SO42-、NH4+;
(2)该溶液中一定不含有的离子是CO32-,故答案为:CO32-;
(3)含有NH4+,且物质的量为0.01mol,含有SO42-,且物质的量为:n=$\frac{2.33g}{233g/mol}$=0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子,如果有硝酸根,那么就大于0.1mol/L,如果没有硝酸根就刚好等于0.1mol/L,即钾离子的浓度≥$\frac{0.01mol×2-0.01mol}{0.1L}$=0.1mol/L,故答案为:是;含有NH4+,且物质的量为0.01mol,含有SO42-,且物质的量为:n=$\frac{2.33g}{233g/mol}$=0.01mol;根据溶液中的电荷守恒,溶液呈电中性,则一定含有钾离子;≥0.1mol/L.
点评 本题考查了溶液中成分的鉴别,离子性质的分析判断,依据物质的性质注意离子之间的反应以及现象是解答的关键,题目难度中等.

①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④还原性:I->Br->Cl-.
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 二核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
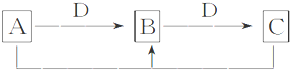
各有关物质之间的相互反应转化关系如图所示:

请填写下列空白:
(1)写出下列B的化学式Cl2,F的电子式
 .;
.;(2)写出反应H+E(溶液)→M的离子方程式:H++ClO-═HClO;
(3)用单线桥表示I与K反应的电子转移方向和数目:
 .
. 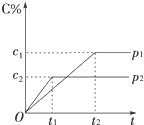 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )| A. | p1>p2 | B. | p1=p2 | C. | m+n>p+q | D. | m+n<p+q |
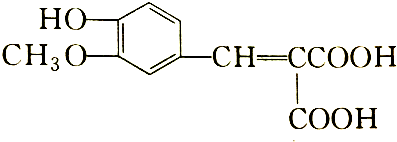 含有的官能团有( )
含有的官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
| A. | 3NO2+H2═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2 |
(1)这六种元素中除H、C、O、P、S外,应该还有N(写元素符号),它的原子最外层共有5种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置第二周期IVA族.CO2是一种温室气体,它的电子式为
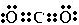 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.(2)糖类是人体获得能量的来源之一.已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804kJ的热量,该反应的热化学方程式C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)△H=-2804kJ•mol-1.
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是D(填序号).
A、离子半径:S2->Na+>O2->H+ B、与水反应的剧烈程度:K>Na>Mg>Ca
C、熔点:CO2>SiO2>Na2O>SO3 D、还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |