题目内容
14.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④还原性:I->Br->Cl-.
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
分析 ①非金属性越强,对应简单氢化物的稳定性越强;
②电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小;
③非金属性越强,最高价氧化物对应水合物的酸性越强;
④非金属性越强,对应离子的还原性越弱.
解答 解:①非金属性:F>O>S,非金属性越强,对应氢化物的稳定性越强,则热稳定性:HF>H2O>H2S,故①错误;
②K原子的电子层最多,其原子半径最大,Mg、S都含有3个电子层,原子序数Mg<S,则原子半径Mg>S,所以原子半径大小为:K>Mg>S,故②正确;
③非金属性P<S<Cl,则最高价氧化物对应水合物的酸性:H3PO4<H2SO4<HClO4,故③错误;
④非金属性I<Br<Cl,非金属性越强,对应离子的还原性越弱,则离子的还原性强弱为:I->Br->Cl-,故④正确;
故选B.
点评 本题考查了元素周期律的内容及应用,题目难度不大,明确元素周期律的内容为解答关键,④为易错点,注意元素金属性强弱与离子还原性的关系,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
4.正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
| A. | H、D、T互为同分异构体 | B. | 次氯酸的结构式为 H-Cl-O | ||
| C. | NH4Cl的电子式 为: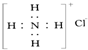 | D. | S2-的结构示意图为: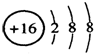 |
5.下列有关化学用语使用正确的是( )
| A. | 硫离子的结构示意 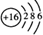 | B. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | ||
| C. | 明矾的化学式:KAlSO4•12H2O | D. | CO2的电子式: |
2.如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )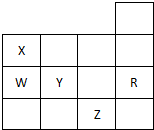

| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
9.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加入过量氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | [Cu(NH3)4]2+中,存在的化学键有离子键、极性共价键和配位键 | |
| D. | 沉淀溶解后,生成深蓝色的配合物SO42- |
19.下列关于物质的分类、性质、用途说法全部正确的是( )
| A. | 水玻璃-混合物氨水-弱碱 | |
| B. | 油脂-天然高分子化合物 有机玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半导体材料硅单质-光纤材料 | |
| D. | 高锰酸钾溶液-氧化性碳酸钠溶液-碱性 |
6.实验室中,用足量的锌粒与一定量的稀盐酸反应,为了减小反应速率,但不影响产生H2的总量,下列措施能达到目的是( )
| A. | 向稀盐酸中加NaNO3溶液 | B. | 向稀盐酸中加碳酸钠固体 | ||
| C. | 将锌粒制成薄片 | D. | 向稀盐酸中加食盐水 |
3.各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 人们回收废旧电池主要是为了防止重金属对水土的污染 | |
| C. | 氢氧燃料电池的能量转化率可达100% | |
| D. | 太阳能电池的主要材料为二氧化硅 |