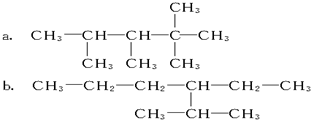
题目内容
13.下列反应中,氧化产物和还原产物的物质的量之比为1:1的是( )| A. | 3NO2+H2═2HNO3+NO | B. | 4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2 | ||
| C. | 3Cl2+8NH3═N2+6NH4Cl | D. | 2Na+2NH3(液)═2NaNH2+H2 |
分析 从元素化合价的角度即化合价升高为还原剂反应生成氧化产物,化合价降低为氧化剂生成还原产物,以此解答该题.
解答 解:A.在反应3NO2+H2═2HNO3+NO中,2NO2化合价升高为还原剂反应生成2HNO3为氧化产物,1NO2化合价又降低为氧化剂生成NO为还原产物,则氧化产物与还原产物的物质的量比为2:1,故A错误;
B.在反应4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2中,4FeS2化合价升高为还原剂反应生成2Fe2O3+8SO2为氧化产物,11O2化合价降低为氧化剂生成2Fe2O3+8SO2为还原产物,则氧化产物与还原产物的物质的量比为1:1,故B正确;
C.在反应3Cl2+8NH3═N2+6NH4Cl中,2NH3化合价升高为还原剂反应生成N2为氧化产物,3Cl2化合价降低为氧化剂生成6NH4Cl为还原产物,则氧化产物与还原产物的物质的量比为1:6,故C错误;
D.在反应中2Na+2NH3(液)═2NaNH2+H2中,2Na化合价升高为还原剂反应生成2NaNH2为氧化产物,2NH3(液)中H化合价降低为氧化剂生成H2为还原产物,则氧化产物与还原产物的物质的量比为2:1,故D错误.
故选B.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂、氧化产物与还原产物的关系来解答,难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
3.各式各样电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 人们回收废旧电池主要是为了防止重金属对水土的污染 | |
| C. | 氢氧燃料电池的能量转化率可达100% | |
| D. | 太阳能电池的主要材料为二氧化硅 |
8.某酸二酯(CPPO)的组成如图所示
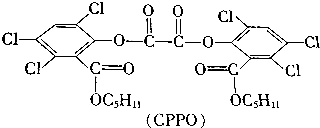
如果苯环上取代基位置和官能团位置都不改变,CPPO的结构有( )

如果苯环上取代基位置和官能团位置都不改变,CPPO的结构有( )
| A. | 32种 | B. | 36种 | C. | 64种 | D. | 72种 |
8.常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HCl 溶液和 20.00mL0.1000mol/L CH3COOH 溶液,得到2条滴定曲线,如图所示:
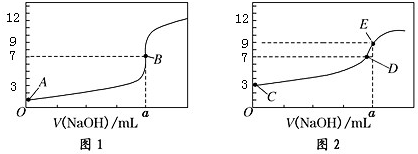
以下说法正确的是( )

以下说法正确的是( )
| A. | 图 1 是滴定 CH3COOH 溶液的曲线 | |
| B. | 图 2 若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 | |
| C. | 点 D 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 如果 C、E 两点对应的 pH 分别为 3、9,则水电离的氢离子浓度之比为 1:100 |
9.下列实验能证明一元酸HA是弱电解质的是( )
| A. | 将25℃1mL pH=3的HA溶液加水稀释至100mL,稀释后溶液的PH=4 | |
| B. | HA溶液与NaHCO3溶液反应放出CO2 | |
| C. | 25℃时,NaA溶液的pH大于7 | |
| D. | 往HA溶液中滴入甲基橙,溶液呈橙色,不呈红色 |
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$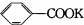 +2MnO2↓+1H2O+(1)KOH
+2MnO2↓+1H2O+(1)KOH 与C按1:1生成高分子化合物的反应方程式为
与C按1:1生成高分子化合物的反应方程式为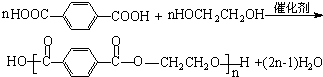 .
.