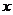19.(09全国卷Ⅱ 27)
27)
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,
它们的物质的量随时间的变化如表所示。

 (1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |



 (2) 体系中发生反应的化学方程式是___________________________;
(2) 体系中发生反应的化学方程式是___________________________;

 (3) 列式计算该反应在0-3min时间内产物Z
(3) 列式计算该反应在0-3min时间内产物Z
的平均反应速率:_______________;

 (4) 该反应达到平衡时反应物X的转化率
(4) 该反应达到平衡时反应物X的转化率
等于___________________________;

 (5) 如果该反应是放热反应。改变实验条件(温
(5) 如果该反应是放热反应。改变实验条件(温
度、压强、催化剂)得到Z随时间变化的曲线
①、②、③(如右图所示)则曲线①、②、③
所对应的实验条件改变分别是:

 ① _________________ ②________________ ③__________________
① _________________ ②________________ ③__________________
[解析
 ](1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
](1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
 (2)根据题意,可以利用“三步法”求解
(2)根据题意,可以利用“三步法”求解
 aX + bY
aX + bY cZ
cZ
 开始 1.00 1.00 0
开始 1.00 1.00 0
 转化 0.45 0.9 0.9
转化 0.45 0.9 0.9
 平衡 0.55 0.1 0.9
平衡 0.55 0.1 0.9
 根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y
根据各物质的量之比可得体系中发生反应的化学方程式是: X+2Y 2Z。
2Z。
 (3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol, 其平均速率为0.083mol/L·min。
 (4)X的转化率等于0.45。
(4)X的转化率等于0.45。
 (5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压21世纪教育网
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压21世纪教育网
[答案]


[考点分析]本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
 C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则
C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则 



 和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO3+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。 = 。
= 。 。
。 等其他合理答案:)
等其他合理答案:) (或其他合理答案:)
(或其他合理答案:) N2O4(g)的平
N2O4(g)的平 ;
; 




 ===
=== 可得
可得
 N2O4(g)达到平衡。
N2O4(g)达到平衡。 应的反应热有无影响? 。该反应通常用V2O5作催化
应的反应热有无影响? 。该反应通常用V2O5作催化 是NO和
是NO和 的混合物(不含
的混合物(不含 )。
)。 烟气最高允许含400mg
烟气最高允许含400mg 水溶液(密度1.16g/mL)作为
水溶液(密度1.16g/mL)作为 ①
① ②
② 时,吸收率最高。
时,吸收率最高。 。
。 烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。