摘要:3.某温度下.将2mo1A和3mo1B充入一密闭容器中.发生反应:aAC.5min 后达到平衡.已知该温度下其平衡常数K=1 .若温度不变时将容器的体积扩大为原来的10倍.A的转化率不发生变化. 则 A.a=1 B.a =2 C.B的转化率为40 % D.B的转化率为60 % [解析]若温度不变时将容器的体积扩大为原来的10倍.A的转化率不发生变化.则压强不影响平衡状态.a=1,AC. 起始物质的量(mol) 2 3 0 0 变化物质的量(mol) x x x x 平衡物质的量(mol)2-x 3-x x x K=1=x2/[] ,X=1.2,则B的转化率为1.2/3=40% [答案]AC
网址:http://m.1010jiajiao.com/timu_id_4426319[举报]
(2008?南通三模)A、B、C、D、E五种元素的原子序数逐渐增大,且均不超过18.其中A与C、B与E分别为同族元素.原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等.下列说法正确的是( )
查看习题详情和答案>>
(2008?南通三模)1986年,人们成功的用如下反应制得了氟:下列说法中正确的是( )
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2
②K2MnF6+2SbF5=2KSbF6+MnF4
③2MnF4=2MnF3+F2↑
①2KMnO4+2KF+10HF+3H2O2=2K2MnF6+8H2O+3O2
②K2MnF6+2SbF5=2KSbF6+MnF4
③2MnF4=2MnF3+F2↑
查看习题详情和答案>>
(2008?南通三模)1,3-丙二醇是重要的化工原料,用乙烯合成1,3-丙二醇的路线如下:
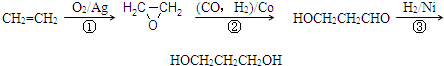
(1)通过反应①用乙烯和空气混合气体制备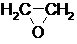 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.
计算此时乙烯的转化率.
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O
CO+H2
CH4+H2O
CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
查看习题详情和答案>>
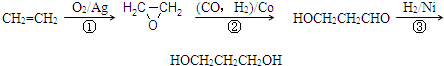
(1)通过反应①用乙烯和空气混合气体制备
| C2H4 | O2 | N2 | ||
| 反应前体积分数 | 25.0% | 15.0% | 60.0% | 0 |
| 某一时刻体积分数 | 5.56% | 5.54% | 66.7% | 22.2% |
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O
| ||
CH4+H2O
| ||
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?