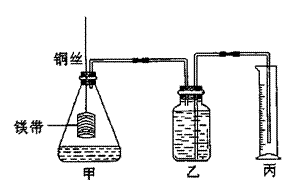
1. (18分)工业生产的纯碱中常含有少量的食盐。某学生为测定纯碱中Na2CO3的质量百分含量,设计了如图实验装置。
(18分)工业生产的纯碱中常含有少量的食盐。某学生为测定纯碱中Na2CO3的质量百分含量,设计了如图实验装置。
操作步骤如下:
①检查装置的气密性;
②在干燥管D、E内填满颗粒状碱石灰,称量D的总持量(W1g);
③称取一定质量的纯碱(W2g),并所它放进广口瓶B里;
④打开分洲漏斗的活塞,将稀硫酸缓缓滴入B瓶中,至不再产生气体为止。
⑤打开弹簧夹a,缓缓鼓入空气约5分钟后,再称干燥管D的总质量(W3g);
(1)A瓶中盛的试剂是 ,作用是 。
(2)C瓶中盛的试剂是 ,作用是 。
(3)鼓入空气的目的是 。
(4)干燥管E的作用是 。
(5)如果去掉装置A,测定结果将(填偏大、偏小或无影响) ;如果去掉装置C,测定结果将 。
(6)计算Na2CO3的质量百分含量的算式为 。
 2.(12分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
2.(12分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH溶液,并置于水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
。
反应完毕生经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解曲线的是
 (填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)
(填写编号字母);从②的试管中分离出该晶体的方法是 (填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是 。
(4)实验中可观察到④的试管里的溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为 色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
|
|
然后溶液从无色逐渐变为 色 |
|
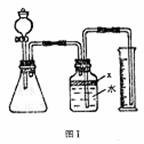 3.(15分)氮化铝(AIN)是一种新型的无机
3.(15分)氮化铝(AIN)是一种新型的无机
材料,广泛应用于集成电路生产领域。某氮
化铝样品中含有碳或氧化铝杂质,现用图I
装置进行实验,使氮化铝样品与NaOH溶液
反应(AIN+NaOH+H2O===NaAlO2+NH3↑),
根据反应所生成氨的体积来测定样品中氮化
铝的质量分数,并根据实验现象确定杂质的
成分。实验过程记录如下:
a.检查装置气密性;b.往锥形瓶中放入适量氮化铝样品,从分液漏斗往锥形瓶中加入过量浓NaOH溶液,立即发生剧烈反应,生成的氨将广口瓶中的水排入量筒中;c.实验结束后,测量量筒中收集到的水的体积(包括由广口瓶到量筒的导管内的水柱的体积),进行计算。
(1)本实验中,检查装置气密性的方法是
(2)广口瓶中的试剂x最好选用 。(填选项的标号)
A.汽油 B.酒精 C.植物油 D.四氯化碳
(3)广口瓶中的液体没有装满(上方留有少量空间),实验结果测得的NH3的体积将
(填“偏大”、“偏小”或“不受影响”)。
(4)实验结束后,若观察到受锥形瓶中还有固体,则样品中含有的杂质是 。(填杂质名称)
(5)若实验中测得样品的质量为wg,氨的体积为aL(已折算成标准状况),则样品中AlN的质量分数为 。(AlN的摩尔质量为41g·mol-1)
 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是( )
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是( )
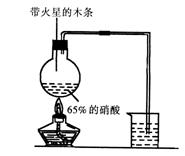 写出浓硝酸受热分解的化学方程式:
写出浓硝酸受热分解的化学方程式:
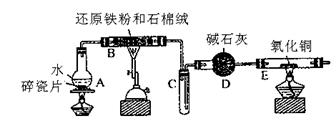


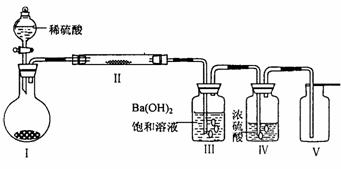 (3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。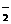 +H2O;2NO2+2OH-=NO
+H2O;2NO2+2OH-=NO +H2O;
+H2O;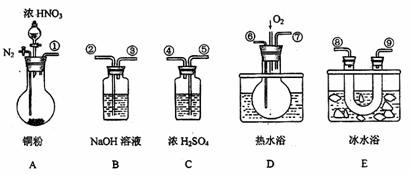
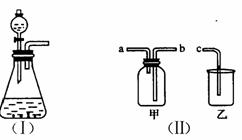 (15分)下图(I)是实验室制取气体的一种发生装置。
(15分)下图(I)是实验室制取气体的一种发生装置。