网址:http://m.1010jiajiao.com/timu3_id_68084[举报]
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:________;若XY2为共价化合物时,其结构式为:_________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是__________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题
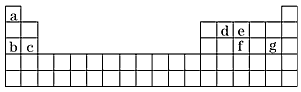
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式_______。
利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。请回答下列问题:
(1)已知COCl2分子的结构式为![]() ,则COCl2分子内含有 (填标号);
,则COCl2分子内含有 (填标号);
A.4个σ键 B.2个σ键、2个π键 C.2个σ键、1个π键 D.3 个σ键、1个π键
(2)Fe(CO)5中铁的化合价为0,写出Fe元素基态原子的价电子排布式 ;Fe(CO)5
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可以判断Fe(CO)5晶体类型为 。
(3)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5=Fe(s)+5CO,反应过程中,断裂的化学键只有配位键,形成的化学键是 。
(4)与CO分子互为等电子体的分子和离子各写出1种,分别为 和 (填化学式)。
查看习题详情和答案>> 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)(1)A、B、C、D的第一电离能由小到大的顺序为
(2)C的氢化物分子是
(3)化合物BD3的分子空间构型是
(4)E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可判断E(CO)5的晶体类型为
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞如图所示.体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为
(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
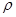 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含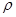 、NA的计算式表示)
、NA的计算式表示)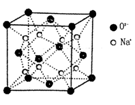 查看习题详情和答案>>
查看习题详情和答案>>
(14分)Ⅰ(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等。
①Cu位于元素周期表第四周期第 族。
②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。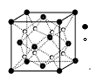
Ⅱ(3)液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
①写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
②下列能说明碳与硫两元素非金属性相对强弱的是 。
A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
③羰基硫在水存在时会缓慢水解生成H2S,使溶液的pH约为6.5左右,此时钢铁设备会产生的电化学腐蚀主要是 。