(1)晶体是内部微粒(原子、离子、分子)在空间按一定规则做 构成的 物质,晶体区别于非晶体的三个特征是:具有 的几何外形,各向 和具有固定的 。
(2)根据晶体内部微粒的 的微粒间 的不同可以将晶体分为通过离子键形成的 晶体,以金属键基本作用形成的 晶体,通过价键形成的 晶体和通过分子间相互作用形成的 晶体。
(3)常见晶体类型比较:
|
晶体类型 类型 比较 |
分子晶体 |
原子晶体 |
离子晶体 |
金属晶体 |
|
|
构成晶体 微粒 |
|
|
|
|
|
|
形成晶体微粒间作用力 |
|
|
|
|
|
|
作用力大小决定因素 |
|
|
|
|
|
|
物理性质 |
熔沸点 |
|
|
|
|
|
硬度 |
|
|
|
|
|
|
导电性 |
|
|
|
|
|
|
传热性 |
|
|
|
|
|
|
延展性 |
|
|
|
|
|
|
溶解性 |
|
|
|
|
|
|
典型实例 |
P4、干冰、硫 |
金刚石、SiO2 |
NaCl、KOH、NH4Cl |
金属单质 |
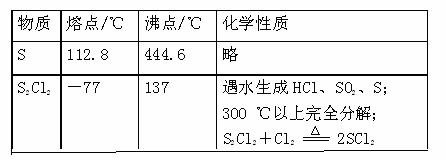
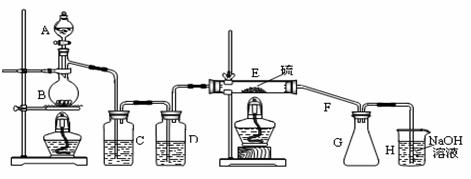
25、(17分)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
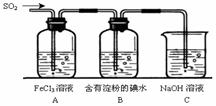 (1)SO2气体还原Fe3+的产物是 、
(1)SO2气体还原Fe3+的产物是 、
(填离子符号),参加反应的SO2和Fe3+的
物质的量之比是 。
(2)下列实验方案适用于在实验室制取所需SO2
的是 (填序号)。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
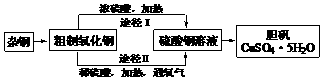
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F. 坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的 , 原因是
(6)能表明I-的还原性弱于SO2的现象是 。30.(13分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质、结构信息 |
价电子数为5的短周期元素;该元素形成的双原子分子一般情况下很稳定。 |
基态原子的M层有1对成对的p电子。 |
第三周期中第一电离能最小的元素 |
原子最外电子层上s电子数等于p电子数。单质为空间网状晶体,具有很高的熔、沸点。 |
(1)写出元素B基态原子的电子排布式___________________________。
(2)元素A形成的气态氢画物的空间构型为______________________。
(3)元素B的氢化物熔点比水低,原因是_______________________。
(4)元素B和元素C形成的化合物属于_____(填“离子”“原子”或“分子”)晶体。
(5)元素D形成的化合物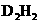 .其中D原子采用 杂化;
.其中D原子采用 杂化;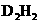 分子中含_____个
分子中含_____个 键、____个
键、____个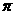 键,其中1个
键,其中1个 键的键能____(填“大于”、“小于”或“等于”)1个
键的键能____(填“大于”、“小于”或“等于”)1个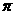 键的键能。
键的键能。
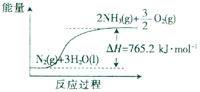
24.(16分)一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O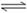 2NH3+
2NH3+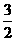 O2.进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
O2.进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
生成NH3量/(10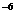 mo1) mo1) |
4.8 |
5.9 |
6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为
 ;
;
(2)该反应过程与能量关系可用右图表示.完成反应的热化学方程式:
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议 ;
(4)工业合成氨的反应为N2(g)+3 H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g)
 N2(g)
十3H2(g)的平衡常数数值为
N2(g)
十3H2(g)的平衡常数数值为
。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.80 mo1,H2为2.0 mol,则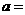 _____,
_____,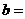 _______。
_______。
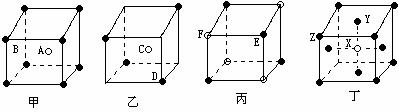
 在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是
结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为
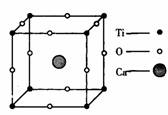
;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。
在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是
结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为
;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。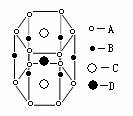
 ②膦(PH3)在水中的溶解度远小于氨的原因是_______________________。
②膦(PH3)在水中的溶解度远小于氨的原因是_______________________。