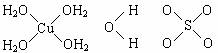3.已知A、B、C、D四种分子所含原子的数目依次为1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1 :2。D是一种有毒的有机物。
(1)组成A分子的原子的元素符号是 ;
(2)从B分子的立体结构判断,该分子属于 分子(填“极性”或“非极性”);
(3)C分子中都包含_______个σ键,_______个π键。
(4)D的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明D是何物质):
______________________________________________________。
Ⅱ.CO的结构可表示为C≡O,N2的结构可表示为N≡N。
(5)下表是两者的键能数据:(单位:kJ/mol)
|
|
A-B |
A=B |
A≡B |
|
CO |
357.7 |
798.9 |
1071.9 |
|
N2 |
154.8 |
418.4 |
941.7 |
结合数据说明CO比N2活泼的原因:______________________________________________
__________________________________________________________。
 Ⅲ.(6)基态Ni原子的核外电子排布式为 __
____ 。
Ⅲ.(6)基态Ni原子的核外电子排布式为 __
____ 。
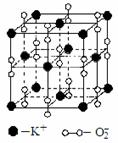
IV.(7)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列说法正确的是
A.超氧化钾的化学式为KO2,每晶胞含有14个K+和13个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧原子与-2价氧原子的数目比为3:1
答案.
(1)Ar。
(2)极性。
(3)5,1。
(4)D是CH3OH,分子之间能形成氢键。
(5)CO中第一个π键的键能是273kJ/mol,N2中第一个π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。
(6)1s22s22p63s23p63d74s2 。(7)D。
4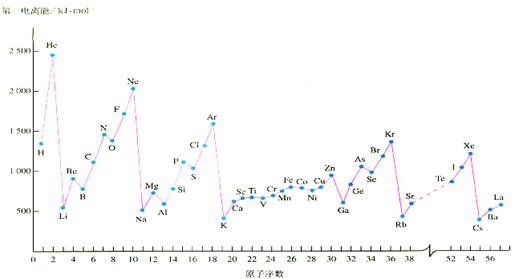 . 教材中给出的各物质的第一电离能的数据如下
. 教材中给出的各物质的第一电离能的数据如下
请回答下列问题:
(1)Al的第一电离能比Mg的低,理由是:__________________________。
(2)稀有气体的第一电离能都处在峰顶,碱金属的第一电离能都处在谷底,原因是:______________________________________________________________。
稀有气体中的Xe能形成氧化物XeO3,已知该氙原子上有1对孤对电子,则XeO3分子构型为_____型结构;Xe的杂化类型为__________________。碱金属的晶胞类型为钾型,其晶胞名称叫:__________________,它的空间利用率比铜型的___________(填:高、低)。
(3)上图中也给出了过渡元素的第一电离能数据,他们都与核外电子的排布有关,则Cr的外围电子排布式为:____________________________________。
(4)Mn 元素的外围电子排布式为3d54s2 ,Fe元素的外围电子排布式为3d64s2 ,请解释Mn的第三电离能比Fe的第三电离能大的原因是:____________________________。
(5)从上图中可以看出N原子的第一电离能与O第一电离能出现了反常现象,这与N原子的核外电子排布的特殊性有关,这样就使氮的单质及化合物具有一些特殊的性质,请回答下列问题:①写出一种与N2互为等电子体的阴离子的路易斯结构式_________________________.②氨分子极易溶于水,原因是:______________________。
③向硫酸铜的溶液中加入少量氨水,产生_____色的沉淀,继续加氨水则形成________色的透明溶液,其阳离子的结构为________________________(要表示出配位键),若加入极性较小的溶剂乙醇,将析出__________色的晶体,该物质的化学式为:_________________。
答案.
(1)镁失去的电子是相对稳定的已充满的3S电子,需要提供额外的能量;铝失去的的是3P电子,3P电子的轨道能比3S电子轨道能高。
(2)稀有气体都达到满电子层结构,失去电子需要提供额外的能量,而碱金属最外层只有一个电子,容易失去。
三角锥形,SP3 杂化。体心立方晶胞,低。
(3)3d54s1
(4)Fe2+转化为Fe3+时,3d能级有不稳定的3d6状态转变为3d5半满状态,所需的能量较小。 (5)①CN- ②氨分子和水分子之间能形成氢键③蓝色,深蓝色,选修3第42页,深蓝色,选修3第42页
1.四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
⑴写出B原子的电子排布式 ▲ 。
⑵A元素的氢化物的沸点比同主族相邻元素氢化物沸点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑶D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 ▲ (填“高”或“低”),其原因是 ▲ 。
⑷往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ▲ ,简要描述该配合物中化学键的成键情况 ▲ 。
 ⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
⑸下列分子结构图中的“
”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ ”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键。
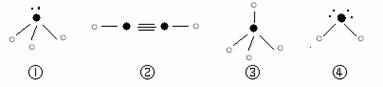
则在以上分子中,中心原子采用sp3杂化形成化学键的是 ▲ (填写序号);在②的分子中有 ▲ 个σ键和 ▲ 个π键。
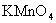 溶液、振荡 (B)加
溶液、振荡 (B)加 溶液、煮沸
溶液、煮沸 水、振荡 (D)加新制碱性
水、振荡 (D)加新制碱性 悬浊液、煮沸
悬浊液、煮沸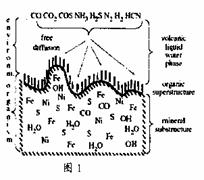 海底热液研究处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围,存活的长管虫、蠕虫、蛤类、 贻贝类等动植物,成了极佳的天然海底实验室,且海底“黑烟囱”周围常存在FeS、黄铜矿及锌矿等矿物。
海底热液研究处于当今科研的前沿。海底热液活动区域“黑烟囱”的周围,存活的长管虫、蠕虫、蛤类、 贻贝类等动植物,成了极佳的天然海底实验室,且海底“黑烟囱”周围常存在FeS、黄铜矿及锌矿等矿物。
 [Cu(NH3)4]2++2OH-+4H2O
正四面体 PO43-、ClO43-
[Cu(NH3)4]2++2OH-+4H2O
正四面体 PO43-、ClO43- 聚合铁(简称PFS)化学式为: [Fe2(OH)n(SO4)3-n/2]m,n<5,m<10 。
聚合铁(简称PFS)化学式为: [Fe2(OH)n(SO4)3-n/2]m,n<5,m<10 。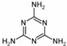 )。下列关于三聚氰胺分子的说法中正确的是 。
)。下列关于三聚氰胺分子的说法中正确的是 。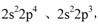 N 原子的 2p 轨道半充满,相对稳定,所以第一电离能大( 1分);sp3 ;三角锥形。
N 原子的 2p 轨道半充满,相对稳定,所以第一电离能大( 1分);sp3 ;三角锥形。