31.(16分)25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如下图所示。已知达平衡后,降低温度,A的转化率将增大。

(1)根据上图数据,写出该反应的化学方程式____________________;此反应的平衡常数表达式K= 。从反应开始到达第一次平衡时的平均速率v(A)为 。
(2) 在5~7min内,若K值不变,则此处曲线变化的原因是 。
(3)下图表示此反应的反应速率v和时间t的关系图
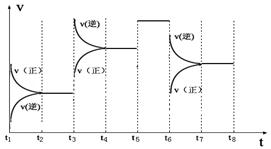
各阶段的平衡常数如下表所示:
|
t2 ~ t3 |
t4 ~ t5 |
t5 ~ t6 |
t7 ~ t8 |
|
K1 |
K2 |
K3 |
K4 |
根据上图判断,在t3和t6时刻改变的外界条件分别是_____________和______________;K1、K2、K3、K4之间的关系为: (用“>”、“<”或“=”连接)。A的转化率最大的一段时间是 。
30.(17分)粗盐提纯的研究。
[有关资料] (Ksp为物质的溶度积常数,其值愈小表示其溶解度愈小)
|
化学式 |
CaCO3 |
CaSO3 |
CaC2O4 |
Mg(OH)2 |
|
Ksp |
4.96×10-9 |
4.96×10-9 |
2.34×10-9 |
5.61×10-12 |
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42-的存在),该小组设计流程如下:

[设计除杂过程]
(1)操作①中需要使用玻璃棒,其作用是 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是_______ _______________ 。
(2)混合液A的主要成分是NaOH和Na2CO3,则反应的离子方程式有______ 。
[检验除杂效果]
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
a.Na2CO3 b.Na2SO3 c.Na2C2O4
[获取纯净食盐]
(4)对溶液B加热并不断滴加6 mol·L-1的盐酸溶液,同时用pH试纸检测溶液,直至pH=7时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到 _ _____________时(填现象),停止加热。
[问题讨论]
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 。
a.加快沉淀生成 b.增加沉淀溶解量 c.使沉淀分解
12.下列实验事实与所得出的相应结论不相符的是 ( )
|
|
实 验 事 实 |
结 论 |
|
A |
氯气通入淀粉碘化钾溶液中,溶液变蓝 |
氧化性:Cl2>I2 |
|
B |
高压钠灯发出透雾性强的光 |
金属钠具有强还原性 |
|
C |
将CO2通入苯酚钠溶液中,出现白色浑浊 |
酸性:碳酸>苯酚 |
|
D |
某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
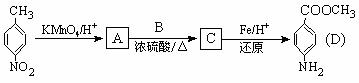
 C的反应类型是 : 。
C的反应类型是 : 。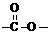 结构的基团的C的所有同分异构体的结构简式:
。
结构的基团的C的所有同分异构体的结构简式:
。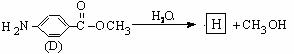
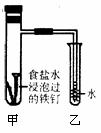 (16分)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(16分)铁及其化合物在日常生活应用广泛,请根据下列实验回答问题: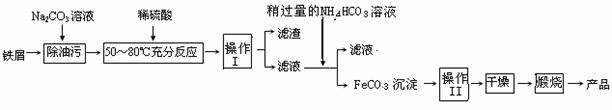
 ③请完成生成FeCO3沉淀的离子方程式:Fe2+ +
HCO3- FeCO3↓+ + H2O
③请完成生成FeCO3沉淀的离子方程式:Fe2+ +
HCO3- FeCO3↓+ + H2O